
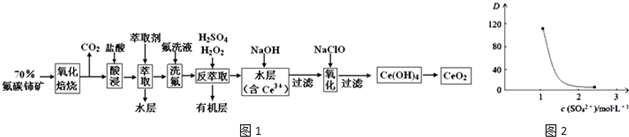
���� ��̼�����Ҫ��CeFCO3�������������ա���Ŀ���ǽ�+3����������+4�ۣ�Ce4+����F-��ϳ�[CeFx]��4-x��+���Ա��������ȡ����ϡ���ᣬ��SO42-��ϳ�[CeSO4]2+������ȡ������ϴҺ��������ϵ��Ce4+�ܱ���ȡ��[��HA��2]��ȡ����Ce3+���ܣ��ӡ�����ȡ����H2O2���ֽ�Ce4+��ԭΪCe3+��������Ӧ2Ce4++H2O2=2Ce3++O2��+2H+��������Ce3+ת��Ϊ������ͨ��������Ce��+3����Ϊ+4���õ���Ʒ��
��1���������ա�ǰ�轫��ʯ�����ϸ������Ϊ�����ӹ����������Ӵ����ȼ�ճ�֣��������������ĽӴ��������Ӧ����֣�
��2����������л������������ɫ����ӦΪ������CeO2�����ᷢ��������ԭ��Ӧ����Ce3+���������������������������������������Ⱦ��
��3��ʵ��������ȡʱ�õ�����Ҫ������������Ϊ��Һ©��������ƽ�⣺Ce4++n��HA��2?Ce•��H2n-4A2n��+4H+������Na2SO4ʱ������c��SO42-������ˮ����Ce4+��SO42-��ϳ�[CeSO4]2+��������ȡƽ�������ƶ���DѸ�ټ�С��
��4��������ȡ����H2O2�������ǽ�Ce4+�������»�ԭΪCe3+����Ӧ�����ӷ���ʽΪ2Ce4++H2O2=2Ce3++O2��+2H+��
��5�����������������ô������ƽ�Ce3+������Ce4+������Ԫ���غ�͵���غ���д���ӷ���ʽ��
��6�����ݵ��ӵ�ʧ�غ�ɵù�ϵʽCeO2��FeSO4������FeSO4�����ʵ����ɼ����CeO2������������ȷ����Ʒ��CeO2������������
��� �⣺��̼�����Ҫ��CeFCO3�������������ա���Ŀ���ǽ�+3����������+4�ۣ�Ce4+����F-��ϳ�[CeFx]��4-x��+���Ա��������ȡ����ϡ���ᣬ��SO42-��ϳ�[CeSO4]2+������ȡ������ϴҺ��������ϵ��Ce4+�ܱ���ȡ��[��HA��2]��ȡ����Ce3+���ܣ��ӡ�����ȡ����H2O2���ֽ�Ce4+��ԭΪCe3+��������Ӧ2Ce4++H2O2=2Ce3++O2��+2H+��������Ce3+ת��Ϊ������ͨ��������Ce��+3����Ϊ+4���õ���Ʒ��
��1�����������ա�ǰ�轫��ʯ�����ϸ��������Ŀ�����������������ĽӴ��������Ӧ����֣�
�ʴ�Ϊ���������������ĽӴ��������Ӧ����֣�
��2����������л������������ɫ����ӦΪ������CeO2�����ᷢ��������ԭ��Ӧ����Ce3+����������Ӧ�����ӷ���ʽΪ2Cl-+8H++2CeO2=2Ce3++4H2O+Cl2�����������������������������������Ⱦ��
�ʴ�Ϊ��2Cl-+8H++2CeO2=2Ce3++4H2O+Cl2����������������
��3��ʵ��������ȡʱ�õ�����Ҫ������������Ϊ��Һ©��������ƽ�⣺Ce4++n��HA��2?Ce•��H2n-4A2n��+4H+������Na2SO4ʱ������c��SO42-������ˮ����Ce4+��SO42-��ϳ�[CeSO4]2+��������ȡƽ�������ƶ���DѸ�ټ�С��
�ʴ�Ϊ����Һ©��������c��SO42-������ˮ����Ce4+��SO42-��ϳ�[CeSO4]2+��������ȡƽ�������ƶ���DѸ�ټ�С��
��4��������ȡ����H2O2�������ǽ�Ce4+�������»�ԭΪCe3+����Ӧ�����ӷ���ʽΪ2Ce4++H2O2=2Ce3++O2��+2H+��H2O2�ڸ÷�Ӧ������ԭ����ÿ��1mol H2O2�μӷ�Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ2mol��
�ʴ�Ϊ����ԭ����2mol��
��5�����������������ô������ƽ�Ce3+������Ce4+����Ӧ�����ӷ���ʽΪ2Ce32Ce��OH��3+NaClO+H2O=2Ce��OH��4+NaCl��
�ʴ�Ϊ��2Ce��OH��3+NaClO+H2O=2Ce��OH��4+NaCl��
��6��FeSO4�����ʵ���Ϊ0.1000mol•L-1��0.025L=0.0025mol�����ݵ��ӵ�ʧ�غ�ɵù�ϵʽCeO2��FeSO4������CeO2������Ϊ0.0025��172g=0.4300g����Ʒ��CeO2����������Ϊ$\frac{0.4300g}{0.4500g}$��100%=95.60%��
�ʴ�Ϊ��95.60%��
���� ���⿼�����ʷ�����ᴿ��Ϊ��Ƶ���㣬�漰���ʷ�����ᴿ����ѡȡ��������ԭ��Ӧ��֪ʶ�㣬��ȷ��Ӧԭ���ǽⱾ��ؼ���֪������ͼ�з����ķ�Ӧ������������������Ŀ�Ѷ��еȣ�


 A�ӽ��� ϵ�д�
A�ӽ��� ϵ�д� ȫ�Ų��Ծ�ϵ�д�
ȫ�Ų��Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | -Y kJ/mol | B�� | -��5X-0.5Y��kJ/mol | C�� | -��10X-Y��kJ/mol | D�� | +��10X-Y��kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| X | ||||||
| Y | Z | W |
| A�� | ��ҵ�ϵ��ZW3������Һұ������Z | |
| B�� | Ԫ��X�����������W�����������ͬ | |
| C�� | �����Ӱ뾶�Ĵ�С˳��r��X-����r��Y+�� | |
| D�� | Y��W������������ˮ��������ܽ����Z |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
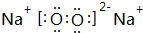 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
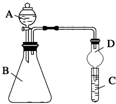 ijͬѧΪ̽��Ԫ�����ڱ���Ԫ�����ʵĵݱ���ɣ����������ϵ��ʵ�飮
ijͬѧΪ̽��Ԫ�����ڱ���Ԫ�����ʵĵݱ���ɣ����������ϵ��ʵ�飮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 mol ����������Ӧ���� Na2O �� Na2O2ʱ��ʧ������Ŀ��Ϊ NA | |
| B�� | 1 mol/L �� NaOH ��Һ�к� Na+��ĿΪ NA | |
| C�� | ��״���£�2.24LC6H6 �����ķ�����ĿΪ 0.1NA | |
| D�� | 1 mol Na2O2 �к��е���������ĿΪ 2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ԫ�ؼȱ������ֱ���ԭ | |
| B�� | �������뻹ԭ�������ʵ���֮��Ϊ1��2 | |
| C�� | ÿ����1molNa2S2O3��ת��4mol���� | |
| D�� | ��ͬ�����£�ÿ����10m3SO2�ͻ�ų�5m3CO2 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com