
【题目】完成下列各小题。
Ⅰ.按要求书写下列化学方程式
(1)2-甲基-1,3-丁二烯与等物质的量的溴发生1,4-加成的反应:_______。
(2)乙醛与新制氢氧化铜悬浊液加热反应:______。
(3)CH3CHClCOOCH2CH3与氢氧化钠水溶液共热:____。
(4)乙二醇和乙二酸脱水成环酯:_____。
Ⅱ.有一种有机物X的键线式如图所示。
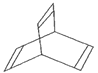
(5)X的分子式为________。
(6)有机物Y是X的同分异构体,且属于芳香族化合物,则Y的结构简式是____。
(7)Y在一定条件下可生成高分子化合物,该反应的化学方程式是___。
(8)X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有____种。
【答案】![]() +Br2→
+Br2→![]() ; CH3CHO+2Cu(OH)2 + NaOH
; CH3CHO+2Cu(OH)2 + NaOH![]() CH3COONa+Cu2O↓+3H2O CH3CHClCOOCH2CH3 +2NaOH
CH3COONa+Cu2O↓+3H2O CH3CHClCOOCH2CH3 +2NaOH![]() CH3CHOHCOONa+CH3CH2OH +NaCl HOCH2CH2OH+HOOCCOOH
CH3CHOHCOONa+CH3CH2OH +NaCl HOCH2CH2OH+HOOCCOOH![]()
![]() +2H2O C8H8
+2H2O C8H8 ![]() n
n![]()
![]()
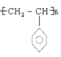 2
2
【解析】
(1) 2-甲基-1,3-丁二烯与等物质的量的溴发生1,4-加成的反应:![]() +Br2→
+Br2→![]() ;
;
(2)在碱性条件,乙醛被氧化生成乙酸钠,新制氢氧化铜悬浊液变为砖红色沉淀Cu2O,乙醛与新制氢氧化铜悬浊液加热反应:CH3CHO+2Cu(OH)2 + NaOH![]() CH3COONa+Cu2O↓+3H2O;
CH3COONa+Cu2O↓+3H2O;
(3)CH3CHClCOOCH2CH3中含有氯原子和酯基可以发生水解,则CH3CHClCOOCH2CH3与NaOH水溶液共热的反应为:CH3CHClCOOCH2CH3+2NaOH![]() CH3CHOHCOONa+CH3CH2OH +NaCl;
CH3CHOHCOONa+CH3CH2OH +NaCl;
(4)乙二醇和乙二酸分子间可以脱两分子水成环酯:HOCH2CH2OH+HOOCCOOH![]()
![]() + 2H2O;
+ 2H2O;
(5)根据X的结构简式,其分子为C8H8;
(6)有机物Y是X的同分异构体,X有5个不饱和度,故Y中除了苯环结构还需要一个碳碳双键结构,则Y的结构简式是![]() ;
;
(7)Y为![]() ,碳碳双键在一定条件下发生加聚生成高分子化合物,该反应的化学方程式是:n
,碳碳双键在一定条件下发生加聚生成高分子化合物,该反应的化学方程式是:n![]()
![]()
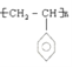 ;\
;\
(8)X与足量的H2在一定条件下反应可生成环状的饱和烃Z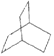 ,Z有两种化学环境不同的氢原子,故Z的一氯代物有2种。
,Z有两种化学环境不同的氢原子,故Z的一氯代物有2种。


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】A、X、Y、Z、Q、R、T 分别代表原子序数依次增大的短周期元素。元素A是原子半径最小的元素;X、Y、Z同周期且相邻,都是蛋白质的组成元素;X、R同族,Q与T原子的最外层电子数之和是R原子最外层电子数的2倍,T单质为淡黄色固体。U是d区元素,U2+的核外最高能级有2对成对电子。请回答下列问题:
(1)Y元素在周期表中的位置______,位于周期表______区;Q原子的核外电子排布式为______。
(2)X、Y、Z元素的第一电离能由大到小的顺序是______。
(3)TZ3分子为______分子(填“极性”或“非极性”),YZ2–离子实际构型是______。
(4)Z和T的简单气态氢化物稳定性好的是______(填化学式),原因是______。
(5)A、X、Z可形成分子式为A2XZ的有机物,则该化合物分子中X原子的轨道杂化类型是______;1mol该分子中含有π键的数目是______。(用“NA”表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:
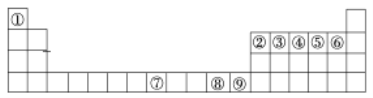
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,元素⑦位于周期表的___区。
(2)写出元素③与元素⑤形成的稳定化合物的结构式______。
(3)②、⑥两元素形成的化合物其中心原子的杂化轨道类型为___。
(4)元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断该化合物晶体属于____晶体(填晶体类型)。
(5)元素⑨的离子的氢氧化物不溶于水,但可溶于氨水,该离子与NH3间结合的作用力为____。
(6)将①、⑥形成的化合物溶于水,其与水间可能存在的氢键表示为____________(写一种即可)。
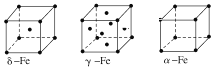
(7)金属⑦有δ、γ、α三种同素异形体,各晶胞如下图,则δ和α中原子的配位数之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示一些晶体中的某些结构,请回答下列问题:
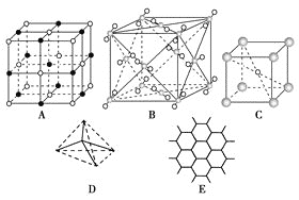
(1)代表金刚石的是(填编号字母,下同)___,其中每个碳原子与____个碳原子最近且距离相等。金刚石属于____晶体。
(2)代表石墨的是____,每个正六边形占有的碳原子数平均为____个。
(3)代表NaCl的是___,每个Na+周围与它最近且距离相等的Na+有___个,每个Na+周围与它最近且距离相等的Cl-有___个。
(4)代表CsCl的是___,它属于____晶体,每个Cs+与____个Cl-紧邻。
(5)代表干冰的是___,它属于___晶体,每个CO2分子与___个CO2分子紧邻。
(6)已知石墨中碳碳键的键长比金刚石中碳碳键的键长短,则上述五种物质熔点由高到低的排列顺序为____(用名称回答)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL浓H2SO4溶液(足量)中加入3.2 g Cu,在加热条件下充分反应:
(1)将题干中反应后的溶液稀释到500 mL,取出50 mL,并向取出液中加入足量的BaCl2溶液,得到沉淀19.81 g,则原浓硫酸的物质的量浓度为____。
(2)若题干中浓硫酸的物质的量浓度为a mol/L,投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)___0.025a mol(填“等于”、“大于”或“小于”)。
(3)反应消耗的H2SO4的物质的量是____,生成SO2的体积为(标准状况下)_____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。
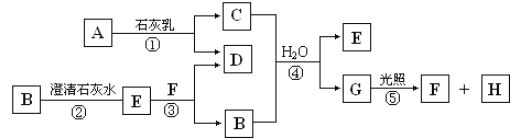
请回答以下问题:
(1)工业上常利用反应①制取漂白粉,该反应的化学方程式:_____,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为____。
(2)A中元素的原子结构示意图为____。
(3)F在溶液中的电离方程式为_____。
(4)上述反应中属于氧化还原反应的是___(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟合成硫酸的流程如下:

从下图中选择制取气体的合适装置:

(1)装置C的名称为__________,实验室通常用装置C制备_____。
A.H2 B.C2H2 C.CO2 D.NH3
(2)实验室用装置D制备O2的化学方程式为____________________。
(3)若用装置B制备SO2,可以选用试剂为_____。
A.浓硫酸、亚硫酸钠固体 B.浓硫酸、铜片
C.稀硫酸、亚硫酸钠溶液 D.浓硫酸、铁屑
(4)SO2和O2通过甲装置,甲装置的作用除了可以控制SO2、O2的流速外,还可以__________、__________。

(5)使用乙处导出的有关气体制成硫酸,下列a、b、c三套装置中你选择的是_______,该套装置与其它装置比较,其优点是___________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应。
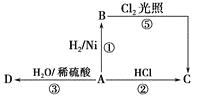
据图回答下列问题:
(1)写出A、C、D的结构简式:
A________,C________,D________。
(2)写出①②两步反应的化学方程式,并注明反应类型:
①________________________________(反应类型____________)。
②________________________________(反应类型____________)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:从石油中获得A是目前工业上生产A的主要途径,A的产量通常用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。
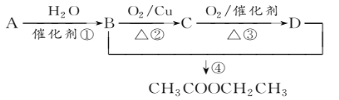
回答下列问题:
(1)写出A的结构简式______________。
(2)B、D分子中的官能团名称分别是_______________、________________。
(3)写出下列反应的反应类型:①_________,②________,④__________。
(4)写出下列反应的化学方程式:
①________________________________________________________________;
②________________________________________________________________。
③________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com