
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。
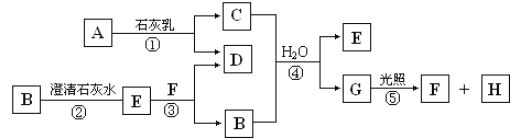
请回答以下问题:
(1)工业上常利用反应①制取漂白粉,该反应的化学方程式:_____,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为____。
(2)A中元素的原子结构示意图为____。
(3)F在溶液中的电离方程式为_____。
(4)上述反应中属于氧化还原反应的是___(填写序号)。
【答案】2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO ![]() HCl=H++Cl- ①⑤
HCl=H++Cl- ①⑤
【解析】
C能与气体B反应得到E,而B与石灰水反应也得到E,题给B为气体,可推知B为CO2,则E为CaCO3,F为HCl;A与石灰乳反应得到C,反应①是重要的工业反应,由此可知,该反应为工业制备漂白粉的反应,所以A为Cl2,C为Ca(ClO)2,D为CaCl2,G为HClO, H为O2,据此来分析作答即可。
(1)B是CO2,D是CaCl2,G是HClO,H是O2;
(2)工业上常利用反应①氯气与石灰乳反应制取漂白粉,该反应的化学方程式:2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO;
(3)A为氯元素,其原子结构示意图为![]() ;
;
(4)F为HCl,在溶液中的电离方程式为HCl=H++Cl-;
(5)上述反应中属于氧化还原反应的是①2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O,氯元素化合价由0价变为+1价和-1价;⑤2HClO![]() 2HCl+ O2↑,氯元素、氧元素化合价均发生改变。
2HCl+ O2↑,氯元素、氧元素化合价均发生改变。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素,它们的相关信息如下:①原子序数依次增大,②A和C的L能层中都有两个未成对的电子,③C、D同主族且位于相邻周期,④E和F的原子序数相差3,F原子除最外能层只有1个电子外,其余各能层均全充满。根据以上信息填空(涉及的具体物质用元素符号或化学式回答):
(2)基态D原子中,具有______种不同能量的电子,E2+的价层电子轨道表达式是______。
(2)六种元素中电负性最强的元素是______。
(3)A元素的最高价氧化物中心原子采取的轨道杂化方式为______,D元素的最简单氢化物的VSEPR模型为______。
(4)与化合物AC2互为等电子体的分子的分子式为______(任写一种,下同),与化合物AC2互为等电子体且含有的元素只能是上述六种元素中的一价阴离子为______。
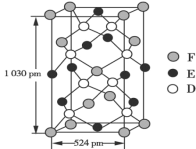
(5)某种化合物由D、E、F三种元素组成,其晶胞结构如图所示,则其化学式为______,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度:ρ=______g·cm-3(只要求列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
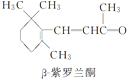
【题目】β紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1。下列说法正确的是
 →……→
→……→ →……→
→……→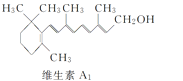
A.β紫罗兰酮与等物质的量的Br2加成反应可生成2种产物
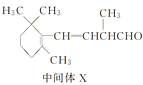
B.1 mol中间体X最多能与2 mol H2发生加成反应
C.维生素A1难溶于NaOH溶液
D.β紫罗兰酮与中间体X互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)![]() X表示原子:
X表示原子:
①AXn+共有x个电子,则该阳离子的中子数N=____。
②12C16O2分子中的中子数N=______。
③A2-原子核内有x个中子,其质量数为m,则n g A2-所含电子的物质的量为_____。
(2)某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图是_____。
(3)已知某粒子的结构示意图为![]()
试回答:①当x-y=10时,该粒子为___(填“原子”、“阳离子”或“阴离子”)。
②写出y=3与y=7的元素最高价氧化物对应水化物发生反应的离子方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列各小题。
Ⅰ.按要求书写下列化学方程式
(1)2-甲基-1,3-丁二烯与等物质的量的溴发生1,4-加成的反应:_______。
(2)乙醛与新制氢氧化铜悬浊液加热反应:______。
(3)CH3CHClCOOCH2CH3与氢氧化钠水溶液共热:____。
(4)乙二醇和乙二酸脱水成环酯:_____。
Ⅱ.有一种有机物X的键线式如图所示。
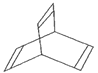
(5)X的分子式为________。
(6)有机物Y是X的同分异构体,且属于芳香族化合物,则Y的结构简式是____。
(7)Y在一定条件下可生成高分子化合物,该反应的化学方程式是___。
(8)X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新“人工固氮”的研究报道:常温常压、光照条件下,N2在催化剂表面与水发生反应:2N2 (g)+6H2O (l) ![]() 4NH3 (g)+3O2 (g) △H= – Q(Q>0) ,如果反应的平衡常数K值变大,该反应( )
4NH3 (g)+3O2 (g) △H= – Q(Q>0) ,如果反应的平衡常数K值变大,该反应( )
A.化学平衡一定向正反应方向移动
B.化学平衡一定向逆反应方向移动
C.在平衡移动时正反应速率增大逆反应速率减小
D.在平衡移动时正反应速率增大逆反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行的实验,能达到相应实验目的的是( )
A.图2:收集NO2气体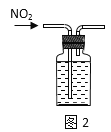
B.图3:验证X溶液为浓硝酸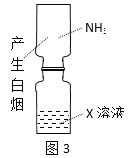
C.图4:验证氨气在水中的溶解性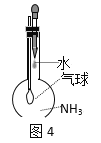
D.图5:用于吸收尾气NH3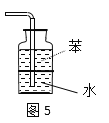
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数,下列说法正确的是( )
A.在反应中消耗0.1molCl2,转移的电子数一定为0.2NA
B.15gCH3+(碳正离子)中含有的电子数为8NA
C.标准状况下,11.2L乙炔中含共用电子对的数目为1.5NA
D.0.1L 2mol/L的(NH4)2S溶液中含有的S2-数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫铁矿烧渣的主要成分为Fe2O3、Fe3O4,以及少量SiO2、Al2O3等。由硫铁矿烧渣制备铁红(Fe2O3)的一种工艺流程如下:

已知:还原焙烧时,大部分Fe2O3、Fe3O4转化为FeO。
几种离子开始沉淀和完全沉淀时的pH如下表所示:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 7.6 | 9.7 |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 4.7 |
(1)“酸浸、过滤”步骤中所得滤液中的金属阳离子有(填离子符号)________________。
(2)Fe粉除调pH外,另一个作用是___________;Fe粉调节溶液的pH为__________。
(3)“沉淀、过滤”步骤中生成FeCO3的离子方程式为_______________________________;
所得滤液的主要溶质是(填化学式)_______________。
(4)高温条件下,“氧化”步骤中发生反应的化学方程式为______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com