
【题目】硫铁矿烧渣的主要成分为Fe2O3、Fe3O4,以及少量SiO2、Al2O3等。由硫铁矿烧渣制备铁红(Fe2O3)的一种工艺流程如下:

已知:还原焙烧时,大部分Fe2O3、Fe3O4转化为FeO。
几种离子开始沉淀和完全沉淀时的pH如下表所示:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 7.6 | 9.7 |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 4.7 |
(1)“酸浸、过滤”步骤中所得滤液中的金属阳离子有(填离子符号)________________。
(2)Fe粉除调pH外,另一个作用是___________;Fe粉调节溶液的pH为__________。
(3)“沉淀、过滤”步骤中生成FeCO3的离子方程式为_______________________________;
所得滤液的主要溶质是(填化学式)_______________。
(4)高温条件下,“氧化”步骤中发生反应的化学方程式为______________________________。
【答案】Fe2+、Fe3+、Al3+ 将溶液中Fe3+还原为Fe2+,便于与Al3+分离 5(4.7~7.6或其之间的任意数值) Fe2++2HCO3-=FeCO3↓+CO2↑+H2O (NH4)2SO4 FeCO3+O2![]() 2Fe2O3+4CO2
2Fe2O3+4CO2
【解析】
硫铁矿烧渣(Fe2O3、Fe3O4,以及少量SiO2、Al2O3等)加入焦炭还原焙烧,大部分Fe2O3、Fe3O4转化为FeO,加入足量硫酸后,溶液中有Fe2+、Fe3+、Al3+,而SiO2不能溶解在酸中,被过滤除去。加入铁粉,把Fe3+还原为Fe2+,同时消耗H+,使溶液的PH增大,除去Al3+,滤液中含有的溶质为FeSO4,加入NH4HCO3,发生反应:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O,得到的被氧气氧化得到Fe2O3。
(1)在硫铁矿烧渣中含有Fe2O3、Fe3O4,以及少量SiO2、Al2O3等,当加入酸时,Fe2O3、Fe3O4、Al2O3发生反应变为Fe2+、Fe3+、Al3+存在于溶液中;而SiO2不能溶解在酸中,被过滤除去;
(2)由于Fe3+、Al3+形成沉淀时的溶液的pH接近,不容易分离,所以加入Fe粉除调pH外,另一个作用是将溶液中Fe3+还原为Fe2+,便于与Al3+分离;由于Al3+沉淀完全的溶液的pH=4.7,而Fe2+沉淀完全的溶液的pH=9.7,所以Fe粉调节溶液的pH为4.7~7.6或其之间的任意数值;
(3)根据题意在“沉淀、过滤”步骤中生成FeCO3的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;由于在过程中加入的是硫酸和NH4HCO3,所以所得滤液的主要溶质是(NH4)2SO4;
(4)高温条件下,FeCO3和O2发生反应产生Fe2O3和CO2,根据电子守恒和元素的原子个数守恒可得该“氧化”步骤中发生反应的化学方程式为FeCO3+O2![]() 2Fe2O3+4CO2。
2Fe2O3+4CO2。


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。
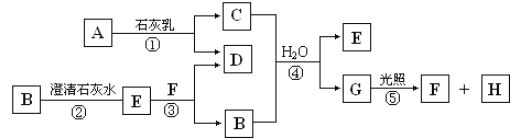
请回答以下问题:
(1)工业上常利用反应①制取漂白粉,该反应的化学方程式:_____,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为____。
(2)A中元素的原子结构示意图为____。
(3)F在溶液中的电离方程式为_____。
(4)上述反应中属于氧化还原反应的是___(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳热还原氯化法从铝土矿中炼铝具有步骤简单、原料利用率高等优点,其原理如下:
Ⅰ.Al2O3(s) + AlCl3(g) + 3C(s) ![]() 3AlCl(g) + 3CO(g) – 1486 kJ
3AlCl(g) + 3CO(g) – 1486 kJ
Ⅱ.3AlCl(g) ![]() 2Al(l) + AlCl3(g) + 140 kJ
2Al(l) + AlCl3(g) + 140 kJ
(1)写出反应Ⅰ的化学平衡常数表达式K=_____________,升高温度,K_______(填增大、减小、不变)。
(2)写出反应Ⅱ达到平衡状态的一个标志_________________________________;结合反应Ⅰ、Ⅱ进行分析,AlCl3在炼铝过程中的作用可以看作___________。
(3)将1mol氧化铝与3mol焦炭的混合物加入2L反应容器中,加入2mol AlCl3气体,在高温下发生反应Ⅰ。若5min后气体总质量增加了27.6g,则AlCl的化学反应速率为_________ mol/(L·min)。
(4)Na2O2具有很强的氧化性。少量Na2O2与FeCl2溶液能发生反应:____Na2O2+ FeCl2+___H2O→____Fe(OH)3↓+_____FeCl3+____NaCl;已知FeCl2前面系数为6,配平上述化学方程式,并标出电子转移方向和数目________________。此反应中被还原的元素是____________,氧化产物是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴滴涕(DDT)是20世纪60年代以前广为应用的一种杀虫剂,其结构简式为

DDT因其稳定性、脂溶性、药效普适性等特点而大量使用,最终造成环境污染。下列关于DDT的说法,不正确的是( )
A.DDT也能杀死有益的生物
B.DDT极易溶于水
C.DDT是烃的衍生物
D.DDT不易被生物分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:从石油中获得A是目前工业上生产A的主要途径,A的产量通常用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。
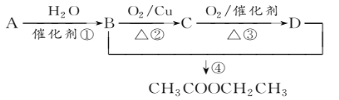
回答下列问题:
(1)写出A的结构简式______________。
(2)B、D分子中的官能团名称分别是_______________、________________。
(3)写出下列反应的反应类型:①_________,②________,④__________。
(4)写出下列反应的化学方程式:
①________________________________________________________________;
②________________________________________________________________。
③________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )
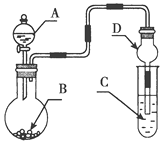
A.若A为浓盐酸,B为KMnO4晶体,C中盛有紫色石蕊溶液,则C中溶液最终呈红色
B.实验仪器D可以起到防止溶液倒吸的作用
C.若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中溶液先产生白色沉淀后沉淀又溶解
D.若A为浓H2SO4,B为Cu,C中盛有澄清石灰水,则C中溶液变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的工艺流程如下:
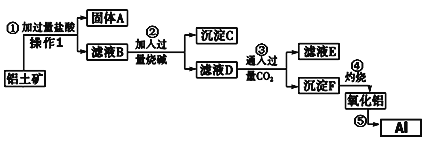
则回答下列问题:
(1)操作1的名称为____________,用到的玻璃仪器除玻璃棒、烧杯外,还需_________;
(2)沉淀C的成分为________________(写化学式);
(3)设计最简实验证明滤液D中Fe3+已沉淀完全(写出操作、现象及结论,试剂任选):取2mL滤液D于试管中,__________________________。
(4)滤液E中的主要溶质的化学式为________________;
(5)写出步骤⑤的化学方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,![]() 。向物质的量浓度相同的
。向物质的量浓度相同的![]() 和
和![]() 的混合溶液中滴加
的混合溶液中滴加![]() 溶液产生
溶液产生![]() 、
、![]() 两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。
两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。
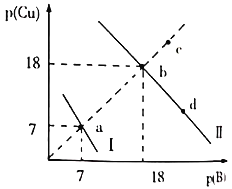
图中的![]() ,
,![]() 或
或![]() 。下列说法错误的是( )
。下列说法错误的是( )
A.曲线Ⅰ表示的是Cu2+与OH-浓度关系的曲线
B.该温度下,![]()
C.升高温度时,b点会向c点移动
D.向d点对应的溶液中加入对应阴离子的钠盐固体,d点向b点移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷精矿湿法制备磷酸的一种工艺流程如下:

已知:磷精矿主要成分为Ca5(PO4)3(OH),还含有Ca5(PO4)3F和有机碳等。溶解度:Ca5(PO4)3(OH)<CaSO4·0.5H2O
(1)上述流程中能加快反应速率的措施有___。
(2)磷精矿粉酸浸时发生反应:2Ca5(PO4)3(OH)+3H2O+10H2SO4![]() 10CaSO4·0.5H2O+6H3PO4
10CaSO4·0.5H2O+6H3PO4
①该反应体现出酸性关系:H3PO4___H2SO4(填“>”或“<”)。
②结合元素周期律解释①中结论:P和S电子层数相同,___。
(3)酸浸时,磷精矿中Ca5(PO4)3F所含氟转化为HF,并进一步转化为SiF4除去。写出生成HF的化学方程式:__。
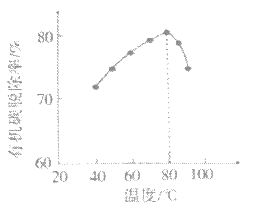
(4)H2O2将粗磷酸中的有机碳氧化为CO2脱除,同时自身也会发生分解。相同投料比、相同反应时间,不同温度下的有机碳脱除率如图所示。80℃后脱除率变化的原因:___。
(5)脱硫时,CaCO3稍过量,充分反应后仍有SO42-残留,加入BaCO3可进一步提高硫的脱除率,其离子方程式是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com