
【题目】某温度下,反应ClF(g)+F2(g) ![]() ClF3(g) △H = -268 kJ·mol-1 在密闭容器中达到平衡。下列说法正确的是 ( )
ClF3(g) △H = -268 kJ·mol-1 在密闭容器中达到平衡。下列说法正确的是 ( )
A. 温度不变,缩小体积,ClF的转化率增大
B. 温度不变,增大体积,ClF3产率提高
C. 升高温度,增大体积,有利于平衡向正反应方向移动
D. 降低温度,体积不变,F2转化率降低
【答案】A
【解析】
本题所列反应是正反应为放热、体积缩小的可逆反应。可依据温度、压强、浓度的变化对平衡的影响以及气体的体积和压强、浓度的关系进行判断。
A、温度不变,缩小气体的体积,使平衡向气体体积增大的正反应方向移动,所以,ClF的转化率增大,选项A正确;B、温度不变,增大体积,其压强必然减小,使平衡向逆反应方向移动。所以,ClF3的产率应降低,不应增高,选项B错误;C、升高温度,对放热反应来说,可使平衡向逆反应方向移动。同时,增大体积即减小压强,亦使平衡向逆反应方向移动,选项C错误;D、降低温度,体积不变,有利于平衡向放热反应方向移动,使F2的转化率升高,选项D错误。答案选A。


科目:高中化学 来源: 题型:
【题目】已知下列反应:
①![]() ;ΔH=
;ΔH=![]() 196.6kJmol-1
196.6kJmol-1
②![]() ;ΔH<0
;ΔH<0
③![]() ;ΔH=
;ΔH=![]() 92.4 kJmol-1
92.4 kJmol-1
(1)在一定条件下向一密闭容器中充入1mol SO2和0.5mol O2,充分反应后,放出的热量_________(填“<”“>”“=”)98.3kJ;理由是_____________________;
(2)反应②的化学平衡常数表达式K=___________,温度降低时,K值_______(填“增大”、“减小”或“无影响”);
(3)在0.2L的密闭容器中,加入1.0mol N2 和 3.0mol H2当该反应达到平衡时,测出平衡混合气的总物质的量为3 mol,则平衡时氮气的转化率=___________;
(4)反应③中为有效提高氢气的转化率,理论上可采取的措施有____________________。
A.升高温度 B.增大压强 C.减小压强 D.及时移出氨 E.循环利用和不断补充氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在一容积不变的密闭容器中发生可逆反应2X(g) ![]() Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
A. 混合气体的密度不再变化 B. 反应容器中Y的质量分数不变
C. X的分解速率与Y的消耗速率相等 D. 单位时间内生成1 mol Y的同时生成2 mol X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知40℃时水的离子积常数为Kw。该温度下, 将浓度为 a mol/L的一元酸HA与 b mol/L的一元碱BOH等体积混合,该溶液呈中性时,下列叙述不正确的是
A. a=b,pH=7
B. 混合溶液的c(H+)=c(OH-)
C. 混合溶液中,c(B+) =c(A-)
D. 混合溶液中,c(OH-)= ![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,在一容积不变的密闭容器中发生可逆反应A(g)+3B(g)![]() 2C(g),其达到平衡状态的标志是( )
2C(g),其达到平衡状态的标志是( )
A. C生成的速率与C分解的速率相等
B. 单位时间生成n mol A,同时生成3n mol B
C. 体系的密度不再变化
D. A、B、C的浓度之比为1∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的有效利用可以缓解温室效应和能源短缺问题。
(1)固态 CO2(干冰)所属晶体类型___________,所含化学键类型为__________(填“非极性键”或“极性键”或“离子键,下同)。CO2与Na2O2反应过程形成化学键类型为______________________________。
(2)中科院的科研人员在Na-Fe3O4和HMCM-22 的表面将CO2转化为烷烃,其过程如下图。
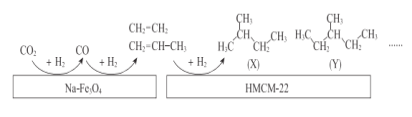
①Na-Fe3O4和HMCM-22 在反应中的作用为_______________。
②写出(X)的所有同分异构体结构简式_______________。
③关于X与Y的说法正确的是__________(填序号〕。
a.最简式相同 b.都有4种一氯代物
c.都易使酸性KMnO4溶液褪色 d.X与Y互称同系物
(3)同温同压下,蒸气密度是氢气15倍的烷烃(M),写出其与氯气反应生成一氯代烃的方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下的容积不变的容器中,当下列物理量不再变化时,表明反应A(g)+2B(g)![]() 3C(g)+D(s)已达到平衡的是( )
3C(g)+D(s)已达到平衡的是( )
① 混合气体的压强 ② 混合气体的密度
③ 混合气体的总质量 ④ 气体的总物质的量
A. ① ④B. ② ③C. ① ② ③D. ① ②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法正确的是
A. 一定条件下,1molN2和3molH2混合后,反应转移的电子数目为6NA
B. 1.0L0.1mol/LNa2S溶液中含有的S2-数为0.1NA
C. 1molCu与含2molH2SO4的浓硫酸充分反应,生成的SO2的分子个数为NA
D. 向含有FeI2的溶液中通入适量氧气,当有1molFe2+被氧化时,该反应转移的电子数目至少为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com