
【题目】回答下列问题:
(1)CuSO4的水溶液呈______(填“酸”“中”或“碱”)性,原因是(用离子方程式表示)___________;实验室在配制CuSO4溶液时,常先将CuSO4固体溶于较浓的硫酸中,然后用蒸馏水稀释到所需的浓度,以_____ (填“促进”或“抑制”)其水解。
(2)泡沫灭火器的灭火原理是(用离子方程式表示)________________________。
(3)已知在25℃:AgCl(s)![]() Ag+(aq)+Cl-(aq) Ksp=1.8×10-10,Ag2S(s)
Ag+(aq)+Cl-(aq) Ksp=1.8×10-10,Ag2S(s) ![]() 2Ag+(aq)+S2-(aq) Ksp=6.3×10-50,向浓度均为0.001 mol/L的NaCl和Na2S的混合溶液中,逐滴加入AgNO3溶液,最先产生的沉淀是________(填“AgCl”或“Ag2S”)。
2Ag+(aq)+S2-(aq) Ksp=6.3×10-50,向浓度均为0.001 mol/L的NaCl和Na2S的混合溶液中,逐滴加入AgNO3溶液,最先产生的沉淀是________(填“AgCl”或“Ag2S”)。
(4)燃料电池能量转化率高,具有广阔的发展前景。天然气燃料电池中,在负极发生反应的物质是 _____(填化学式);如果该电池中的电解质溶液是KOH溶液,电极B电极上发生的电极反应式是:_____________。

【答案】酸 Cu2++2H2O≒Cu(OH)2+2H+ 抑制 Al3++3HCO3-=3CO2↑+Al(OH)3↓ Ag2S CH4 O2+4e-+2H2O=4OH-
【解析】
(1)CuSO4是强酸弱碱盐,铜离子水解方程式为Cu2++2H2OCu(OH)2+2H+,水解后溶液中c(H+)>c(OH-),所以溶液呈酸性,即常温下pH<7;为防止CuSO4水解,所以配制CuSO4溶液时将CuSO4先溶于较浓的硫酸中,抑制其水解,然后稀释,故答案为:酸;Cu2++2H2OCu(OH)2+2H+;抑制;
(2)HCO3-和Al3+均可发生双水解反应,产生气体CO2和沉淀Al(OH)3,离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑,故答案为:Al3++3HCO3-═3CO2↑+Al(OH)3↓;
(3)由于25℃:AgCl(s)![]() Ag+(aq)+Cl-(aq) Ksp=1.8×10-10,Ag2S(s)
Ag+(aq)+Cl-(aq) Ksp=1.8×10-10,Ag2S(s) ![]() 2Ag+(aq)+S2-(aq) Ksp=6.3×10-50,浓度均为0.001 mol/L的NaCl和Na2S的混合溶液,c(Cl-)= c(S2-),要产生氯化银沉淀,需要c(Ag+)=
2Ag+(aq)+S2-(aq) Ksp=6.3×10-50,浓度均为0.001 mol/L的NaCl和Na2S的混合溶液,c(Cl-)= c(S2-),要产生氯化银沉淀,需要c(Ag+)=![]() =1.8×10-7mol/L,要产生硫化银沉淀,需要c(Ag+)=
=1.8×10-7mol/L,要产生硫化银沉淀,需要c(Ag+)=![]() =
=![]() ×10-24mol/L,因此逐滴加入AgNO3溶液,最先产生的沉淀是硫化银,故答案为:Ag2S;
×10-24mol/L,因此逐滴加入AgNO3溶液,最先产生的沉淀是硫化银,故答案为:Ag2S;
(4)燃料电池中,通入燃料的为负极,通入氧气或空气的为正极。天然气燃料电池中,在负极发生反应的物质为甲烷;在电解质溶液为KOH溶液时,正极的电极反应式为O2+4e-+2H2O=4OH-,故答案为:CH4;O2+4e-+2H2O=4OH-。


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】只给出下列甲和乙中对应的物理量,不能求出物质的量的是( )
A.甲:物质中的粒子数;乙:阿伏加德罗常数
B.甲:标准状况下的气体摩尔体积;乙:标准状况下的气体的体积
C.甲:固体的体积;乙:固体的密度
D.甲:溶液中溶质的物质的量浓度;乙:溶液体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:①O2 ②铝 ③Na2O ④CO2 ⑤H2SO4 ⑥Ba(OH)2 ⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨盐酸 ⑩CaCO3
(1)按物质的树状分类法填写表格的空白处:
_________ | 氧化物 | _________ | _________ | 电解质 | |
属于该类的物质 | ② | _________ | ⑧ ⑨ | ⑦ | _________ |
(2)写出实验室制备①的化学方程式:____________________。
(3)上述十种物质中,有两种物质之间可发生H++OH-=H2O,该离子反应对应的化学方程式为_________________。
(4)写出制备⑦的化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是:
A.原子晶体的熔点一定高于离子晶体
B.P4 和 CH4 都是正四面体分子,键角都为 109°28’
C.NaCl 晶体中与每个 Na+距离相等且最近的 Na+共有 6 个
D.C60 气化和 I2 升华克服的作用力相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,在两个起始容积都为1 L的恒温密闭容器发生反应:H2(g)+I2(g)![]() 2HI(g) ΔH<0。实验测得:v正=2v(H2)消耗=2v(I2)消耗=k正c(H2)·c(I2),v逆=v(HI)消耗=k逆c2(HI),k正、k逆为速率常数,受温度影响。下列说法正确的是
2HI(g) ΔH<0。实验测得:v正=2v(H2)消耗=2v(I2)消耗=k正c(H2)·c(I2),v逆=v(HI)消耗=k逆c2(HI),k正、k逆为速率常数,受温度影响。下列说法正确的是
容器 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度 | ||
c(H2) | c(I2) | c(HI) | ||
Ⅰ(恒容) | 0.1 | 0.1 | 0 | c(I2)=0.07 mol·L-1 |
Ⅱ(恒压) | 0 | 0 | 0.6 | |
A. 反应过程中,容器Ⅰ与容器Ⅱ中的物质的量比为1∶3
B. 两容器达平衡时:c(HI,容器Ⅱ)>3c(HI,容器Ⅰ)
C. 温度一定,容器Ⅱ中反应达到平衡时(平衡常数为K),有K=k正/k逆成立
D. 达平衡时,向容器Ⅰ中同时再通入0.1 mol I2和0.1 mol HI,则此时v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌是一种常用金属,冶炼方法有火法和湿法。回答下列问题:
I.镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。
(1)Ga在元素周期表中的位置为___________。
(2)下列有关镓和镓的化合物的说法正确的是___________(填字母)。
A一定条件下,Ga可溶于盐酸和氢氧化钠溶液
B常温下,Ga可与水剧烈反应放出氢气
C.Ga2O3可由Ga(OH)3受热分解得到
D一定条件下,Ga2O3可与NaOH反应生成盐
Ⅱ工业上利用锌熔砂(主要含ZnO、ZnFe2O4,还含有少量 CaO, FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示:
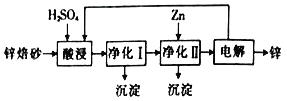
已知:Fe的活泼性强于Ni。
(3) ZnFe2O4可以写成ZnO·Fe2O3,写出ZnFe2O4与H2SO4反应的化学方程式:___________。
(4)净化Ⅰ工操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,仅使Fe3+转化为Fe(OH)3沉淀,净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是______________________。
(5)净化Ⅱ中加入Zn的目的是______________________。
Ⅲ.(6)某化学课外小组拟用废旧电池锌皮(含杂质铁),结合如图所示信息,从提供的试剂中选取适当试剂,制取纯净的ZnSO4·7H2O。
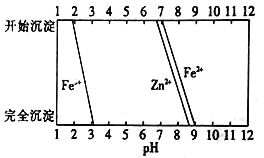
实验步骤如下:
①将锌片完全溶于稍过量的3mol·L-1的稀硫酸,加入___________(填字母,下同);
A.30%H2O2 B新制氯水 C.FeCl3溶液 D.KSCN溶液
②加入___________;
A纯锌粉 B纯碳酸钙粉末 C.纯ZnO粉末 D.3mol·L-1的稀硫酸
③加热到60℃左右并不断搅拌;
④趁热过滤得ZnSO4溶液,再蒸发浓缩、冷却结晶,过滤、洗涤、干燥。
其中步骤③加热的主要目的是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】425℃时,向某V L的密闭容器中充入2molH2(g)和2mol I2(g)发生反应: H2(g)+I2(g)![]() 2HI(g)
2HI(g)![]() =-26.5kJ/mol,测得各物质的物质的量浓度与时间变化的关系如图所示。
=-26.5kJ/mol,测得各物质的物质的量浓度与时间变化的关系如图所示。

请回答下列问题:
(1)V=__________.
(2)该反应达到最大限度了的时间是____________,该时间内平均反应速率v(HI)=________________。
(3)该反应达到平衡状态时,__________(填“吸收”或“放出”)的热量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,图①是细胞中化合物含量的扇形图,图②是有活性的细胞中元素含量的柱形图,下列说法不正确的是( )


A.若图①表示正常细胞中化合物含量的扇形图,则甲、乙化合物共有的元素中含量最多的是a
B.若图①表示细胞完全脱水后化合物含量的扇形图,则甲化合物是生命活动的主要承担者
C.图②中含量最多的元素a与正常情况下细胞中含量最多的化合物无关
D.若图①表示正常细胞中化合物含量扇形图,则乙化合物具有多样性,其必含的元素为C、H、O、N
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com