
【题目】下列说法中正确的是:
A.原子晶体的熔点一定高于离子晶体
B.P4 和 CH4 都是正四面体分子,键角都为 109°28’
C.NaCl 晶体中与每个 Na+距离相等且最近的 Na+共有 6 个
D.C60 气化和 I2 升华克服的作用力相同
科目:高中化学 来源: 题型:
【题目】工业上用氢气与氯气的的反应生产盐酸。
若一定量氢气在氯气中燃烧,所得混合物用100mL 3.0mol/L NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含NaClO的物质的量为0.0500mol。
(1)写出氯气与氢氧化钠溶液反应的化学方程式______________________。
(2)原NaOH溶液的质量分数为_____________________________。(保留三位小数)
(3)所得溶液中Cl-的物质的量为____________________________。
(4)求所用氯气和参加反应的氢气的物质的量之比____________________________。(写出计算过程)
(5)若将H2和Cl2充分混合后,在光照条件下会发生爆炸。现取一份H2和Cl2组成的混合气体经光照充分反应后,通入1000mL 0.1mol/L的NaOH溶液中,如图表示某种离子的物质的量随通入气体的体积变化曲线。当n=0.02mol时,光照前的混合气体中H2和Cl2的物质的量之比为________(已知HClO为弱酸,在水中主要以分子形式存在)
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常见物质间的转化关系,其中甲、乙、丙均为非金属单质;A、B、E和丁均为化合物,其中A常温下呈液态;B和E为能产生温室效应的气体,且1mol E中含有10mol电子。乙和丁为黑色固体,将他们混合后加热发现固体由黑变红。

(1)写出化学式:甲______;乙______;丙______;
(2)丁的摩尔质量______;
(3)写出丙和E反应生成A和B的化学方程式___________;
(4)有同学将乙和丁混合加热后收集到的标准状态下气体4.48L,测得该气体是氢气密度的16倍,若将气体通入足量澄清石灰水,得到白色沉淀物___g;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.4 mol某气体的体积为9.8L,则该气体的摩尔体积为_____。
(2)标准状况下,测得1.92克某气体的体积为672mL,则此气体的相对分子质量为___。
(3)实验室用Na2CO3·10H2O晶体配制0. 5mol/L的Na2CO3溶液970mL,应称取Na2CO3·10H2O的质量是____。
(4)某学生欲用12mol·L-1浓盐酸和蒸馏水配制500 mL 0.3 mol·L-1的稀盐酸。
①该学生需要量取____mL上述浓盐酸进行配制。
②下列实验操作会导致所配制的稀盐酸的物质的量浓度偏小的是____(填序号)。
a.用量筒量取浓盐酸时俯视观察凹液面
b.将量取浓盐酸的量筒进行洗涤,并将洗涤液转移到容量瓶中
c.稀释浓盐酸时,未冷却到室温即转移到容量瓶中
d. 定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
e.容量瓶洗涤干净后未干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华传统文化蕴含着很多科学知识,下列说法错误的是
A. “丹砂(HgS烧之成水银,积变又还成丹砂”描述的是可逆反应
B. “水声冰下咽,沙路雪中平”未涉及化学变化
C. “霾尘积聚难见路人”形容的霾尘中有气溶胶,具有丁达尔效应
D. “含浆似注甘露钵,好与文园止消渴”说明柑橘糖浆有甜味,可以止渴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在一定条件下,可与苯发生化学反应的是( )
①浓硝酸②溴水③溴的四氯化碳溶液④酸性KMnO4溶液⑤氧气
A. ①⑤B. ②④C. ②③⑤D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)CuSO4的水溶液呈______(填“酸”“中”或“碱”)性,原因是(用离子方程式表示)___________;实验室在配制CuSO4溶液时,常先将CuSO4固体溶于较浓的硫酸中,然后用蒸馏水稀释到所需的浓度,以_____ (填“促进”或“抑制”)其水解。
(2)泡沫灭火器的灭火原理是(用离子方程式表示)________________________。
(3)已知在25℃:AgCl(s)![]() Ag+(aq)+Cl-(aq) Ksp=1.8×10-10,Ag2S(s)
Ag+(aq)+Cl-(aq) Ksp=1.8×10-10,Ag2S(s) ![]() 2Ag+(aq)+S2-(aq) Ksp=6.3×10-50,向浓度均为0.001 mol/L的NaCl和Na2S的混合溶液中,逐滴加入AgNO3溶液,最先产生的沉淀是________(填“AgCl”或“Ag2S”)。
2Ag+(aq)+S2-(aq) Ksp=6.3×10-50,向浓度均为0.001 mol/L的NaCl和Na2S的混合溶液中,逐滴加入AgNO3溶液,最先产生的沉淀是________(填“AgCl”或“Ag2S”)。
(4)燃料电池能量转化率高,具有广阔的发展前景。天然气燃料电池中,在负极发生反应的物质是 _____(填化学式);如果该电池中的电解质溶液是KOH溶液,电极B电极上发生的电极反应式是:_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2在生产、生活中有着广泛的用途。
(1)请你列举一个SO2在生活中的用途:______________________。
(2)SO2在工业上常用于硫酸生产:2SO2(g)+O2(g)![]() 2SO3(g),该反应在一定条件下进行时的热效应如图所示,则其逆反应的活化能为__________________。
2SO3(g),该反应在一定条件下进行时的热效应如图所示,则其逆反应的活化能为__________________。
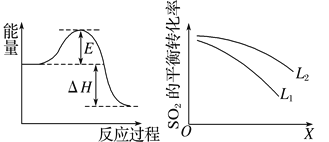
(3)上图中L、X表示物理量温度或压强,依据题中信息可判断:
①X表示的物理量是_________________________,
②L1________(填“>”“<”或“=”)L2。
(4)在容积固定的密闭容器中,起始时充入0.2molSO2和0.1molO2,反应体系起始总压强为0.1MPa。反应在一定的温度下达到平衡时SO2的转化率为90%。该反应的压强平衡常数Kp=__________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)利用原电池原理,也可用SO2和O2来制备硫酸,该电池用多孔材料作电极。请写出该电池负极的电极反应式:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应N2(g)+3H2(g)![]() 2NH3(g),在容积为10 L的密闭容器中进行,开始时加入2 mol N2和3 mol H2,则达到平衡时,NH3的浓度不可能为( )
2NH3(g),在容积为10 L的密闭容器中进行,开始时加入2 mol N2和3 mol H2,则达到平衡时,NH3的浓度不可能为( )
A. 0.1 mol·L-1 B. 0.2 mol·L-1 C. 0.05 mol·L-1 D. 0.15 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com