
【题目】煤气化和液化是现代能源工业中重点考虑的能源综合利用方案。最常见的气化方法为用煤生产水煤气,而当前比较流行的液化方法为用煤生产CH3OH。
(1)已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H1
2CO(g)+O2(g)=2CO2(g)△H2
2H2(g)+O2(g)=2H2O(g)△H3
则反应CO(g)+2H2(g)=CH3OH(g)的△H=_____。
(2)如图是该反应在不同温度下CO的转化率随时间变化的曲线。

①T1和T2温度下的平衡常数大小关系K1_____K2是不后填“>”、“<”或“=”)。
②由CO合成甲醇时,CO在250℃、300℃、350℃下达到平衡时转化率与压强的关系曲线如下图所示,则曲线c所表示的温度为_____℃。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是_____。

③以下有关该反应的说法正确的是_____(填序号)
A.恒温、恒容条件下,若容器内的压强不再发生变化,则可逆反应达到平衡
B.一定条件下,H2的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡。
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率。
D.某温度下,将2mo1CO和6molH2充入2L密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol·L-1,则CO的转化率为80%
(3)一定温度下,向2L固定体积的密闭容器中加入1molCH3OH(g),发生反应:CH3OH(g)![]() CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。
CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。

0~2min内的平均反应速率v(CH3OH)=_____。该温度下,反应CO(g)+2H2(g)![]() CH3OH(g)的平衡常数K=_____。相同温度下,在一个恒容容器中加入一定量的CO和H2,发生反应2H2(g)+CO(g)=CH3OH(g)的平衡常数K=_____.相同温度下,若开始时加入CH3OH(g)的物质的量是原来的2倍,则____是原来的2倍。
CH3OH(g)的平衡常数K=_____。相同温度下,在一个恒容容器中加入一定量的CO和H2,发生反应2H2(g)+CO(g)=CH3OH(g)的平衡常数K=_____.相同温度下,若开始时加入CH3OH(g)的物质的量是原来的2倍,则____是原来的2倍。
A.平衡常数 B. CH3OH的平衡浓度 C.达到平衡的时间 D.平衡时气体的密度
【答案】![]() > 350 在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失 AD 0.125molL-1min-1 0.25 4 D
> 350 在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失 AD 0.125molL-1min-1 0.25 4 D
【解析】
(1)已知:①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1
②2CO(g)+O2(g)═2CO2(g)△H2
③2H2(g)+O2(g)═2H2O(g)△H3
可利用盖斯定律将①+![]() ×②- -
×②- -![]() ×③计算CO(g)+2H2(g)═CH3OH(g)的△H=
×③计算CO(g)+2H2(g)═CH3OH(g)的△H=![]() ;
;
(2)①由图象可知升高温度CO的转化率降低,说明平衡逆向移动;
②升高温度CO的转化率降低,曲线c转化来看最低,温度应最高,即为350℃,根据CO在不同温度下的平衡转化率与压强的关系图2,可以知道在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失;
③A.反应前后气体的物质的量不等,恒温、恒容条件下同,若容器内的压强不发生变化,可说明可逆反应达到平衡;
B.无论是否达到平衡状态,都存在H2的消耗速率是CO的消耗速率的2倍;
C.催化剂不能使平衡发生移动;
D.计算c(CO)以及剩余CO的物质的量,可计算转化率.
(3)平衡时氢气的浓度为0.5mol/L,v(H2)=![]() =0.25molL-1min-1,则v(CH3OH)=0.125molL-1min-1,计算平衡浓度,可计算平衡常数,CO(g)+2H2(g)CH3OH(g)的平衡常数是该反应的逆反应,体积不变的容器中,反应物与生成物全是气体,质量加倍,密度加倍。
=0.25molL-1min-1,则v(CH3OH)=0.125molL-1min-1,计算平衡浓度,可计算平衡常数,CO(g)+2H2(g)CH3OH(g)的平衡常数是该反应的逆反应,体积不变的容器中,反应物与生成物全是气体,质量加倍,密度加倍。
(1)已知:①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1
②2CO(g)+O2(g)═2CO2(g)△H2
③2H2(g)+O2(g)═2H2O(g)△H3
可利用盖斯定律将①+![]() ×②-
×②-![]() ×③计算CO(g)+2H2(g)═CH3OH(g)的△H=
×③计算CO(g)+2H2(g)═CH3OH(g)的△H=![]() ;,
;,
故答案为:![]() ;
;
(2)①由图象可知升高温度CO的转化率降低,说明平衡逆向移动,则K减小,即K1>K2,故答案为:>;
②升高温度CO的转化率降低,曲线c转化来看最低,温度应最高,即为350℃,根据CO在不同温度下的平衡转化率与压强的关系图2,可以知道在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失,
故答案为:350;在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增,得不偿失;
③A. 反应前后气体的物质的量不等,恒温、恒容条件下同,若容器内的压强不发生变化,可说明可逆反应达到平衡,故A正确;
B. 无论是否达到平衡状态,都存在H2的消耗速率是CO的消耗速率的2倍,不能判断是否达到平衡状态,故B错误;
C. 使用合适的催化剂能缩短达到平衡的时间,但不能使平衡发生移动,故C错误;
D. 某温度下,将2molCO和6molH2充入2L密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则剩余0.4molCO,则CO的转化率为(2mol0.4mol)÷2mol×100%=80%,故D正确,
故答案为:AD;
(3)平衡时氢气的浓度为0.5mol/L,v(H2)=![]() =0.25molL-1min-1,则v(CH3OH)=0.125molL-1min-1,
=0.25molL-1min-1,则v(CH3OH)=0.125molL-1min-1,

代入公式K=0.5×0.5×0.25÷0.25=0.25,求得该反应的化学平衡常数为0.25(molL)2。
CO(g)+2H2(g)CH3OH(g)的平衡常数是该反应的逆反应,所以系数是其倒数,应为4,
体积不变的容器中,反应物与生成物全是气体,质量加倍,故密度加倍,
故答案为:0.125molL-1min-1;0.25;4;D。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中进行可逆反应2NO2(g)![]() 2NO(g)+O2(g),下列可以作为反应达到化学平衡状态标志的有( )
2NO(g)+O2(g),下列可以作为反应达到化学平衡状态标志的有( )
A.单位时间内生成nmolO2的同时生成2nmolNO
B.NO2、NO、O2的物质的量之比为2:2:1的状态
C.密闭容器中压强不再改变的状态
D.密闭容器中气体的密度不再改变的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷分子中的 4个氢原子都被苯基取代,可得到分子结构为的有 机物,对该有机物的下列叙述中正确的是()。
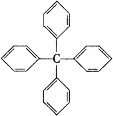
A.分子式为 C25H24
B.属于苯的同系物
C.所有碳原子有可能处于同一平面上
D.在一定条件下,能发生取代、加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g);ΔH=+QkJ·mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
Si(s)+4HCl(g);ΔH=+QkJ·mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C.反应至4min时,若HCl浓度为0.12mol·L-1,则H2反应速率为0.03mol·L-1·min-1
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷主要用于汽油抗爆剂的添加剂,还可用作有机合成和蒸熏消毒用的溶剂。实验室用乙醇、浓硫酸制备乙烯并合成1,2-二溴乙烷,反应原理为:CH2 = CH2 + Br2→CH2BrCH2Br,反应装置如图(加热装置省略)。
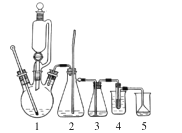
实验步骤:
①如图组装好仪器,在冰水冷却下,将 24 mL 浓硫酸缓慢加入到 12 mL 乙醇中,混合均匀后取 6 mL 加入到三颈烧瓶中,剩余部分倒入恒压滴液漏斗中。
②取一支 20 mL 的吸滤管,量取 3.0 mL(0.1 mol)液溴倒入吸滤管中,再加入 3~5 mL 水,将吸滤管放入 4 的烧杯中。
③加热装置 1 前,先切断装置 3 与 4 的连接处,待温度上升到约 120 ℃时,大部分空气已被排出,然后连接 3 与 4,待温度上升到约 170 ℃时有乙烯产生,开始缓慢滴加乙醇-硫酸混合液,并维持温度在 170~200 ℃左右,当溴的颜色全部褪去,反应即告结束。
④反应完成后,先取下吸滤管,再停止加热。将产物转移至分液漏斗中,依次以等体积的水、1%氢氧化钠水溶液各洗一次,再用水洗两次至中性。加入适量无水氯化钙干燥粗产品,过滤、蒸馏,收集 129~132℃的馏分,产量 5.7g。回答下列问题:
(1)乙烯与溴的反应类型为 _______反应,组装好仪器后必须先 _____________。
(2)装置 1 为乙烯发生器,反应中浓硫酸的作用是 ____________________。
(3)装置 2 为安全瓶,若系统发生堵塞,2 中的现象为 ____________________。
(4)制备乙烯时,常伴有乙醇被氧化的副反应,生成二氧化碳、二氧化硫等气体、则装置 3 洗气瓶中的试剂为________,若去掉装置3,则装置 4 中可能发生的副反应的化学方程式为 ___________________。
(5)若 1 中滴速过快,可能产生的影响为乙烯来不及与溴反应而跑掉,同时也会带走一部分溴进入装置 5(5% 氢氧化钠溶液),降低产率。装置4吸滤管中加水的目的是________。已知该条件下溴与NaOH 反应的氧化产物只有NaBrO3,写出该反应的离子方程式 _____________。
(6)计算本实验的产率:______________ (保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二镍(Ni2O3)可用于制造高能电池元件。电解法制备过程如下:用NaOH 溶液将NiCl2溶液的pH调至7.5(该pH下溶液中的Ni2+不沉淀),加入适量硫酸钠固体后进行电解。电解过程中产生的Cl2(不考虑Cl2的逸出)在弱碱性条件下生成ClO﹣,ClO﹣再把二价镍(可简单写成Ni2+)氧化为Ni3+,再将Ni3+经一系列反应后转化为Ni2O3,电解装置如图所示。下列说法不正确的是( )

A. 加入适量硫酸钠的作用是增加离子浓度,增强溶液的导电能力
B. 电解过程中阴、阳两极附近溶液的pH均升高
C. 当有1mol Ni2+氧化为Ni3+时,外电路中通过的电子数目为1NA,通过阳离子交换膜的Na+数目为1NA
D. 反应前后b池中Cl- 浓度几乎不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向0.1mol/LNH3·H2O溶液中通入HCl气体,溶液中![]() 与pOH(仿pH定义)的关系如图所示。下列有关叙述正确的是
与pOH(仿pH定义)的关系如图所示。下列有关叙述正确的是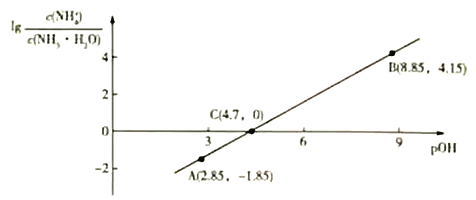
A. C点的溶液中:c(NH3·H2O)>c(NH4+)
B. pOH=7的客液中的溶质是NH4Cl
C. pOH=3的客液中:c(NH4+)+c(H+)+c(NH3·H2O)-c(OH-)=0.1mol/L
D. NH3·H2O的Kb=1.0×10-4.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中充入 NO2,发生反应:2NO2(g) ![]() N2O4(g)。其它条件相同时,不同温度下平衡体系中各物质的物质的量分数如下表:(已知:N2O4 为无色气体)
N2O4(g)。其它条件相同时,不同温度下平衡体系中各物质的物质的量分数如下表:(已知:N2O4 为无色气体)
t/℃ | 27 | 35 | 49 | 70 |
NO2% | 20 | 25 | 40 | 66 |
N2O4% | 80 | 75 | 60 | 34 |
下列说法不正确的是
A.27℃时,该平衡体系中 NO2 的转化率为![]()
B.平衡时,NO2的消耗速率为N2O4消耗速率的2倍
C.室温时,将盛有NO2的密闭玻璃球放入冰水中其颜色会变浅
D.增大NO2起始量,可增大相同温度下该反应的化学平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是(已知质子交换膜只允许H+通过)( )
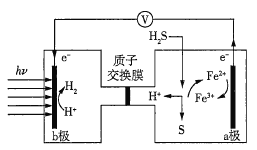
A.该制氢工艺中光能最终转化为化学能
B.该装置工作时,H+由b极区流向a极区
C.a极上发生的电极反应为Fe3++e-=Fe2+
D.a极区需不断补充含Fe3+和Fe2+的溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com