
【题目】2SO2(g)+O2(g) ![]() 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
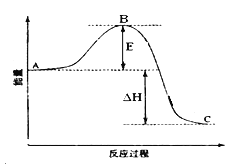
已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ·mol-1。
请回答下列问题:
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热 (填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”还是“降低”),△H (填“变大”、“变小”或“不变”)。
(2)图中△H= kJ·mol-1;
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= - 24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= - 47.2kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
【答案】(1)反应物总能量;生成物总能量;无;降低;不变(2)—198
(3)CO(g)+FeO(s)=Fe(s)+C02(g)△H=-218.00kJ/mol
【解析】
试题分析:(1)根据图像可知图中A、C分别表示反应物总能量,生成物总能量;根据图像,E为(正反应)活化能;反应热=生成物的总能量-反应物的总能量,E的大小对该反应的反应热无影响;催化剂能改变反应路径,使反应所需的活化能降低;但不能改变反应热;
(2)反应热=生成物的总能量-反应物的总能量,则ΔH=—198kJ·mol-1;
(3)已知;①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= - 24.8kJ/mol
②3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= - 47.2kJ/mol
③Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
则根据盖斯定律可知(①×3-③×2+②)÷6即得到CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式为CO(g)+FeO(s)=Fe(s) + C02(g) △H=-218.00 kJ/mol。


科目:高中化学 来源: 题型:
【题目】CCTV“科技博览”栏目报道,我国科学家首创以CO2为原料制备可降解塑料——聚二氧化碳。下列相关说法合理的是( )
A. 聚二氧化碳塑料属于高分子化合物
B. 聚二氧化碳塑料是无机化合物
C. 聚二氧化碳塑料中含有CO2分子
D. 使用聚二氧化碳塑料易造成环境污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液,经测定ClO-与ClO3-的浓度之比为1∶3,则反应时被还原的氯元素与被氧化的氯元素的质量之比为 ( )
A.4∶1 B.3∶1 C.11∶3 D. 21∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某手机电池采用了石墨烯电池,可充电5分钟,通话2小时。一种石墨烯锂硫电池(2Li+S8=Li2S8)工作原理示意图如图。已知参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量。下列有关该电池说法不正确的是
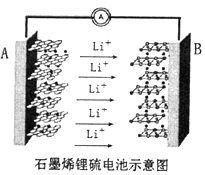
A. 金属锂是所有金属中比能量最高的电极材料
B. A电极为该电源的负极,发生氧化反应
C. B电极的反应:2Li++S8+2e-=Li2S8
D. 电子从A电极经过外电路流向B电极,再经过电解质流回A电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热也是△H=-57.3kJ/mol
B. CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g) △H=+566kJ/mol
C. 需要加热才能发生的反应一定是吸热反应
D. 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学工业中会产生大带含铬废水,需进行无害化处理检测达标后才能排放。
(1)工业常用NaHSO3还原法处理,方法如下:向酸性废水中加入NaHSO3使Cr2O72- 还原成为Cr3+,然后加入熟石灰调节废水的pH,使Cr3+完全沉淀。
① 写出NaHSO3与Cr2O72-反应的离子方程式:__________________________________。
②已知25℃时Ksp[Cr(OH)3]=6.4×10-31。若除去废水中Cr3+,使其浓度小于1×10-5 molL-1,此时溶液中的c(H+)<_________molL-1
(2)废水中铬元素总浓度的测定方法如下:向一定量含Cr2O72-和Cr3+的酸性废水样中加入足量(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;再加入过量的KI溶液,Cr2O72-与I-完全反应后生成Cr3+和I2后,以淀粉为指示剂,用Na2S2O3标准溶液滴定至终点。测定过程中物质的转化关系如下:Cr3+ ![]() Cr2O72-
Cr2O72- ![]() I2
I2 ![]() S4O62-
S4O62-
①上述操作过程中,若无煮沸操作,则测定的铬元素总浓度会________(选填“偏大”、“偏小”或“不变”)。
②准确移取含Cr2O72-和Cr3+的酸性废水样100.00 mL,按上述方法测定废水样中铬元素总浓度,消耗0.01000 molL-1的Na2S2O3标准溶液13.50 mL。计算该废水中铬元素总浓度(以mg·L-1表示),写出计算过程。_____________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在250C某稀溶液中,由水电离产生的c(H+)=10-13mol/L,下列有关溶液的叙述正确的是( )
A.该溶液一定呈酸性 B.该溶液一定呈碱性
C.该溶液的pH可能为1 D.该溶液的pH为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017届湖北省孝感市高三上第一次统考】甲醇是重要的工业原料。煤化工可以利用煤炭制取水煤气从而合成甲醇:
CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
已知①常压下反应的能量变化如图所示。

②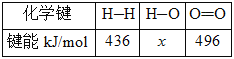
③CO(g)+1/2O2(g)===CO2(g) ΔH=-280kJ/mol
H2(g)+1/2O2(g)===H2O(l) ΔH=-284kJ/mol
H2O(l)===H2O(g) ΔH=+ 44kJ/mol
请回答下列问题:
(1)请写出表示气态甲醇燃烧热的热化学方程式_________________________。
(2)H—O键的键能x为_________kJ/mol。
(3)甲醇气体分解为CO和H2两种气体的反应的活化能为_________kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】想一想:Ba(OH)2(固体) 、铜、 水(液体)这些物质为什么能归为一类,下列物质中还可以与它们归为一类的是( )
A.75%酒精 B.氢氧化铁胶体 C.硝酸钠 D.粗盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com