
【题目】化学工业中会产生大带含铬废水,需进行无害化处理检测达标后才能排放。
(1)工业常用NaHSO3还原法处理,方法如下:向酸性废水中加入NaHSO3使Cr2O72- 还原成为Cr3+,然后加入熟石灰调节废水的pH,使Cr3+完全沉淀。
① 写出NaHSO3与Cr2O72-反应的离子方程式:__________________________________。
②已知25℃时Ksp[Cr(OH)3]=6.4×10-31。若除去废水中Cr3+,使其浓度小于1×10-5 molL-1,此时溶液中的c(H+)<_________molL-1
(2)废水中铬元素总浓度的测定方法如下:向一定量含Cr2O72-和Cr3+的酸性废水样中加入足量(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;再加入过量的KI溶液,Cr2O72-与I-完全反应后生成Cr3+和I2后,以淀粉为指示剂,用Na2S2O3标准溶液滴定至终点。测定过程中物质的转化关系如下:Cr3+ ![]() Cr2O72-
Cr2O72- ![]() I2
I2 ![]() S4O62-
S4O62-
①上述操作过程中,若无煮沸操作,则测定的铬元素总浓度会________(选填“偏大”、“偏小”或“不变”)。
②准确移取含Cr2O72-和Cr3+的酸性废水样100.00 mL,按上述方法测定废水样中铬元素总浓度,消耗0.01000 molL-1的Na2S2O3标准溶液13.50 mL。计算该废水中铬元素总浓度(以mg·L-1表示),写出计算过程。_____________________________________________________
【答案】 3HSO3-+ Cr2O72-+5H+ = 2Cr3++3SO42-+4H2O 2.5×10-6 偏大 I2+2S2O32-= 2I-+S4O62-
n(I2)= ![]()
=![]()
=6.750×l0-5 mol(2分)
n[Cr2O72-]=1/3 n(I2)=2.250×l0-5 mol
n(Cr元素)=2 n[Cr2O72-]=4.500×l0-5 mol
废水样中铬元素总浓度= ![]() =23.40 mg·L-1
=23.40 mg·L-1
【解析】(1)① Cr2O72-具有强氧化性,在酸性条件下,可以将HSO3-氧化为SO42-,自身被还原为Cr3+,反应的离子方程式是3HSO3-+ Cr2O72-+5H+ = 2Cr3++3SO42-+4H2O;
②当c(Cr3+)=10-5mol/L时,溶液的c(OH-)=![]() mol/L=4×10-7 mol/L,c(H+)=
mol/L=4×10-7 mol/L,c(H+)=![]() =2.5×10-6 mol/L;
=2.5×10-6 mol/L;
(2)① 若无煮沸操作,则过量(NH4)2S2O8消耗Cr2O72-,所以则测定的铬元素总浓度会偏高;
②I2+2S2O32-= 2I-+S4O62-
n(I2)= ![]() =
=![]() =6.750×l0-5 mol;
=6.750×l0-5 mol;
n[Cr2O72-]=1/3 n(I2)=2.250×l0-5 mol,n(Cr元素)=2 n[Cr2O72-]=4.500×l0-5 mol,废水样中铬元素总浓度= ![]() =23.40 mg·L-1。
=23.40 mg·L-1。


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是( )
2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时生成2n molNO2
②用NO2、NO、O2的物质的量浓度变化表示的反应速率比为2∶2∶1的状态
③混合气体的颜色不再改变的状态
④混合气体的密度不再改变的状态
⑤混合气体的平均摩尔质量不再改变的状态
⑥混合气体的压强不再改变的状态
A. ①②③④ B. ③④⑤⑥ C. ①③⑤⑥ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,某平衡体系中含有X、Y、Z、W四种物质,此温度下发生反应的平衡常数表达式为: ![]() 。有关该平衡体系的说法正确的是
。有关该平衡体系的说法正确的是
A.升高温度.平衡常数K一定增大
B.增大压强.W(g)质量分数增加
C.升高温度.若混合气体的平均相对分子质量变小.则正反应是放热反应
D.增大X(g)浓度.平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b是两根石墨棒。下列叙述正确的是

A. a是正极,发生还原反应
B. b是阳极,发生氧化反应
C. 稀硫酸中硫酸根离子的物质的量不变
D. 往滤纸上滴加酚酞试液,a极附近颜色变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法中,正确的是( )
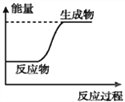
A. 等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量少
B. 如图可表示C和H2O(g)反应过程中的能量变化
C. 吸热反应一定要加热,才能进行
D. 已知中和热为57.3 kJ·mol-1,则浓硫酸与NaOH溶液反应生成 1mol H2O时, 共放出57.3 kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在未知液中加入AgNO3溶液有白色沉淀生成,加入稀硝酸后,沉淀部分溶解,有无色无味的气体牛成,将气体通人澄清石灰水,石灰水变浑浊,由此判断水溶液中含有( )
A.Cl-,S042-
B.Cl-,NO3-
C.Cl-,CO32-
D.Cl-,OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,已知⑤为短周期元素,其单质为淡黄色固体,据表回答有关问题:
① | ② | ||||||
③ | ④ | ⑤ | ⑥ | ⑦ | |||
⑧ | ⑨ |
(1)画出元素⑧的原子结构示意图 __________________
(2)在这些元素中,最活泼的非金属元素是 ______, 最不活泼的元素是_____(写元素符号 )。
(3)在这些元素的最高价氧化物对应水化物中, 碱性最强的是 __________(写化学式),呈两性的氢氧化物是____________(写化学式),写出两者之间反应的离子方程式: ______________________________
(4)在⑥与⑨中,化学性质较活泼的是________(写元素符号 ),写出可以验证该结论的一个化学反应方式 _________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取n g该种氨基酸放在纯氧气中充分燃烧,生成CO2、H2O和N2。现按图所示装置进行实验:

请回答下列有关问题:
(1)实验开始时,首先要通入一段时间的氧气,其理由是____________________;
(2)以上装置中需要加热的仪器有________(用字母填空)。操作时应先点燃________处的酒精灯;
(3)装置D的作用是___________________________________;
(4)读取N2体积时,应注意:①_____________________;②__________________。
(5)实验中测得N2的体积为V mL(已折算为标准状况)。为确定此氨基酸的分子式,还需要的有关数据有________(用字母填空)。
A.生成CO2气体的质量 B.生成H2O的质量
C.通入O2的体积 D.氨基酸的相对分子质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com