
【题目】现有含有少量KC1、K2SO4、K2CO3杂质的KNO3溶液,选择适当的试剂除去杂质,得到纯净的KNO3固体,实验流程如下图所示。
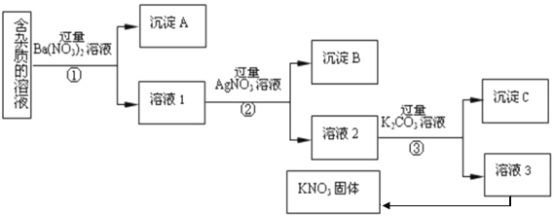
注:KNO3固体容易受热分解
(1)沉淀A的主要成分是___________、___________(填化学式);
(2)为了除去溶液3中的杂质,可以向其中加入适量的___________;除杂后从溶液3获得KNO3晶体的操作是___________、___________、过滤;
(3)步骤③加入过量K2CO3溶液的目的是___________;
(4)实验室用上述实验获得的KNO3体配制450mL0.40 mol/L KNO3溶液,需称取KNO3固体的质量是_____g;
(5)下列操作会导致所配溶液浓度偏大的是(___________)
A.使用了生锈的砝码
B.定容时仰视刻度线
C.容量瓶使用前用蒸馏水洗净但没有干燥
D.固体溶解后未冷却到室温就转移到容量瓶中
【答案】BaSO4 BaCO3 HNO3 蒸发浓缩 冷却结晶 除Ag+ 和 Ba2+ 20.2 AD
【解析】
根据实验流程图,分析各步发生的反应及沉淀的成分和滤液中的溶质,分析实验操作中仪器使用及注意事项。
根据流程图得:①加入过量硝酸钡,生成硫酸钡和碳酸钡沉淀;②加入过量硝酸银,生成氯化银沉淀;③加入过量碳酸钾,生成碳酸银和碳酸钡沉淀,除去过量的硝酸银和过量的硝酸钡;
(1)由上述分析得沉淀A的主要成分是BaSO4、 BaCO3,
故答案为:BaSO4、 BaCO3;
(2)溶液3中的杂质为碳酸钾,可以向其中加入适量的硝酸;从溶液3获得KN03晶体的操作是蒸发浓缩 、冷却结晶、过滤,
故答案为:HNO3、蒸发浓缩、冷却结晶;
(3)根据流程图分析步骤③加入过量K2C03溶液的目的是除Ag+ 和 Ba2+,
故答案为:除Ag+ 和 Ba2+;
(4) 配制450mL溶液选用500mL容量瓶,n(KN03)=cV=0.40 mol/L![]() =0.2mol,m(KN03)=nM=0.2mol×101g/mol=20.2g,
=0.2mol,m(KN03)=nM=0.2mol×101g/mol=20.2g,
故答案为:20.2;
(5)分析溶液中浓度的误差,根据c=![]() 进行分析:
进行分析:
A.使用了生锈的砝码,砝码质量增大,导致称取药品质量偏大,最终浓度偏大,故A正确;
B.定容时仰视刻度线,导致溶液的体积偏大,浓度偏小,故B错误;
C.容量瓶使用前用蒸馏水洗净但没有干燥,并不影响溶液的浓度,故C错误;
D.当溶液冷却时,溶液体积偏小,导致浓度偏大,故D正确;
故选AD。


科目:高中化学 来源: 题型:
【题目】苯乙烯是重要的基础有机化工原料。工业中以乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH=CH2)的反应方程式:
 △H(1)已知:
△H(1)已知:
化学键 | C-H | C-C | C=C | H-H |
键能/kJ·molˉ1 | 412 | 348 | 612 | 436 |
计算上述反应的△H=________ kJ·mol-1。
(2)一定条件下,在体积不变的密闭容器中,反应过程中各物质浓度随时间变化的关系如下图所示。在t1时刻加入H2,t2时刻再次达到平衡。物质X为__________,判断理由是_______________________。

(3)在体积为2L的恒温密闭容器中通入2mol乙苯蒸汽,2分钟后达到平衡,测得氢气的浓度是0.5mol/L,则乙苯蒸汽的反应速率为_________________;维持温度和容器体积不变,向上述平衡中再通入1mol氢气和1mol乙苯蒸汽,则v正_______v逆(填“大于”、“小于”或“等于”)。
(4)实际生产时反应在常压下进行,且向乙苯蒸气中掺入水蒸气,利用热力学数据计算得到温度和投料比M对乙苯平衡转化率的影响可用如图表示。[M=n(H2O)/n(乙苯)]

① 比较图中A、B两点对应的平衡常数大小:KA________KB
② 图中投料比(M1、M2、M3)的大小顺序为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药用有机化合物A(C8H8O2)为一种无色液体。从A出发可发生如图所示的一系列反应。则下列说法正确的是
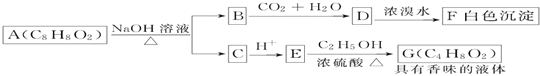
A. 根据D和浓溴水反应生成白色沉淀可推知D为三溴苯酚
B. 上述各物质中能发生水解反应的有A、B、D、G
C. G的同分异构体中属于酯且能发生银镜反应的有2种
D. 1molA能与lmolNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol/L某一元酸(HA)溶液中![]() =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A. 溶液中水电离出的c(H+)=10-10 mol/L
B. 溶液中c(H+)+c(A-)=0.1 mol/L
C. 溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
D. 与0.05mol/LNaOH溶液等体积混合后所得溶液中离子浓度大小关系为c(A-)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的N2、O2、CO2混合气体通过一定量Na2O2后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2物质的量之比为( )
A. 6: 7: 3 B. 3: 3: 2
C. 3: 4: 1 D. 6: 9: 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱酸的电离平衡常数如表:
(1)室温下①0.1 mol·L-1 HCOONa,②0.1 mol·L-1 NaClO,③0.1 mol·L-1 Na2CO3,④0.1 mol·L-1
NaHCO3溶液的pH由大到小的关系为_____________________________________。
(2)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO![]() 、CO
、CO![]() 、HSO
、HSO![]() 、HCO
、HCO![]() 浓度由大到小的顺序为___________________________________。
浓度由大到小的顺序为___________________________________。
(3)下列离子方程式正确的是________(填字母)。
a.2ClO-+H2O+CO2===2HClO+CO![]() b.2HCOOH+CO
b.2HCOOH+CO![]() ===2HCOO-+H2O+CO2↑
===2HCOO-+H2O+CO2↑
c.H2SO3+2HCOO-===2HCOOH+SO![]() d.Cl2+H2O+2CO
d.Cl2+H2O+2CO![]() ===2HCO
===2HCO![]() +Cl-+ClO-
+Cl-+ClO-
(4)某温度(T ℃)下的溶液中,c(H+)=10-xmol·L-1,c(OH-)=10-y mol·L-1,x与y的关系如图所示.

① 此温度下,0.01mol/L的NaOH溶液中水电离出的OH-浓度为_____。
②在此温度下,0.1 mol·L-1的NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1 mol·L-1Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
0.1 mol·L-1NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
按丁方式混合后,所得溶液显________(填“酸”“碱”或“中”)性.写出按乙方式混合后,反应的离子方程式:__________________________。按甲方式混合后,所得溶液的pH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。

(1)写出基态时Q元素原子的电子排布式__________,J元素原子的外围电子排布图________________。
(2)下列对比正确的是__________。
a.原子半径H>G>B>A b.第一电离能E>D>C>B
c.电负性A>H>G>Q d.最高价氧化物的水化物酸性B>A>H>G
(3)关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是______。
a.L位于元素周期表第五周期ⅠA族,属于s区元素
b.O位于元素周期表第七周期Ⅷ族,属于ds区元素
c.M的外围电子排布式为6s1,属于ds区元素
d.H所在族的外围电子排布式为ns2np2,属于p区元素
Ⅱ、已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是元素周期表中原子半径最小的元素,D3B中阴、阳离子具有相同的电子层结构,B、C均可分别与A形成10电子分子,B、C属同一周期,两者可以形成许多种共价化合物,C、F属同一主族,B原子最外电子层的p能级上的电子处于半满状态,C的最外层电子数是内层电子数的3倍,E最外层电子数比最内层多1。请用具体的元素回答下列问题:
(4)F、G元素对应的最高价含氧酸中酸性较强的化学式为__________。
(5)第一电离能:B__________C,电负性:C__________F。(填“<”、“>”或“=”)
(6)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1∶1,X的电子式为____________,试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式__________。
(7)写出E与D的最高价氧化物对应的水化物反应的化学方程式______________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铂(Pt)及其化合物用途广泛。
(1)在元素周期表中,Pt与Fe相隔一个纵行、一个横行,但与铁元素同处_____族。基态铂原子有2个未成对电子,且在能量不同的原子轨道上运动,其价电子排布式为____________。
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体。科学研究表明,顺式分子具有抗癌活性。
①吡啶分子是大体积平面配体,其结构简式如图所示。每个吡啶分子中含有的σ键数目为________。
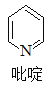
②二氯二吡啶合铂中存在的微粒间作用力有________(填序号)。
a.离子键 b.氢键 c.范德华力 d.金属键 e.非极性键
③反式二氯二吡啶合铂分子是非极性分子,画出其结构式:_____。
(3)某研究小组将平面型的铂配合物分子进行层状堆砌,使每个分子中的铂原子在某一方向上排列成行,构成能导电的“分子金属”,其结构如图所示。
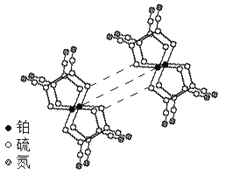
① 硫和氮中,第一电离能较大的是______。
②“分子金属”可以导电,是因为______能沿着其中的金属原子链流动。
③“分子金属”中,铂原子是否以sp3的方式杂化?简述理由:______。
(4)金属铂晶体中,铂原子的配位数为12,其立方晶胞沿x、y或z轴的投影图如图所示。若金属铂的密度为d g·cm-3,则晶胞参数a=_________________nm(列计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖。轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是

A. 该化合物的名称为乙酸乙酯
B. 1mol该化合物与2 mol Br2发生加成反应
C. 该化合物既能发生水解反应,又能发生氧化反应
D. 该化合物的同分异构体中,能与NaHCO3反应放出CO2的只有2种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com