
【题目】H3PO4与NaOH溶液反应的体系中,含磷的各种粒子的分布分数(平衡时某粒子的浓度占各粒子浓度之和的分数)与pH 的关系如下图所示。下列有关说法不正确的是

A. 在pH=13时,溶液中主要含磷粒子浓度大小关系为c(HPO42-)>c(PO43-)
B. 为获得尽可能纯的NaH2PO4,pH应控制在4~5.5 左右
C. 在pH=7.2时,HPO42-、H2PO4-的分布分数各为0.5,则H3PO4的Ka2=10-7.2
D. 由图中数据分析可知Na2HPO4 溶液显碱性
【答案】A
【解析】
A项、由图可知,在pH=13时,c(HPO42-)<c(PO43-),故A错误;
B项、由图可知,HPO42-的分布分数最多时,溶液pH在4~5.5左右,所以为获得尽可能纯的NaH2PO4,pH应控制在4~5.5左右,故B正确;
C、H2PO4-的电离方程式为:H2PO4—![]() HPO42-+H+,Ka2=c(HPO42-)c(H+)/c(H2PO4—),因pH=7.2时,c(HPO42-)=c(H2PO4—),则Ka2= c(H+)=10-7.2,故C正确;
HPO42-+H+,Ka2=c(HPO42-)c(H+)/c(H2PO4—),因pH=7.2时,c(HPO42-)=c(H2PO4—),则Ka2= c(H+)=10-7.2,故C正确;
D项、HPO42-离子既能发生电离又能发生水解,电离方程式为HPO42-![]() PO43-+H+,Ka3=c(PO43-)c(H+)/c(HPO42-),当c(HPO42-)=c(PO43-)时,pH约为12.5,则Ka3=10-12.5,水解方程式为HPO42-+H2O
PO43-+H+,Ka3=c(PO43-)c(H+)/c(HPO42-),当c(HPO42-)=c(PO43-)时,pH约为12.5,则Ka3=10-12.5,水解方程式为HPO42-+H2O![]() H2PO4-+OH-,Kh= c(H2PO4-)c(OH-)/c(HPO42-)=Kw/Ka2=10—14/10-7.2=10-6.8,因Kh>Ka3,说明水解程度大于电离程度,溶液呈碱性,故D正确。
H2PO4-+OH-,Kh= c(H2PO4-)c(OH-)/c(HPO42-)=Kw/Ka2=10—14/10-7.2=10-6.8,因Kh>Ka3,说明水解程度大于电离程度,溶液呈碱性,故D正确。
故选A。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24LCl2通入NaOH溶液中反应转移的电子数为0.2NA
B. 常温下,1LpH=11的NaOH溶液中由水电离出的H+的数目为10-11NA
C. 273K、101kPa下,22.4L由NO和O2组成的混合气体中所含分子总数为NA
D. 100g34%双氧水中含有H-O键的数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,请回答下列问题:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 | |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)在这些元素中,单质的化学性质最不活泼的是___(填元素符号)。
(2)③的气态氢化物的电子式___,②④形成的气态化合物的结构式___。
(3)这些元素形成的最高价氧化物的水化物中,碱性最强的化合物为___(填物质的化学式),写出它的电子式:___;酸性最强的含氧酸为___(填物质的化学式),写出它的电离方程式:___。
(4)在②和③两种元素中,非金属性较强的是___(填元素名称),②的单质可以和③的最高价氧化物的水化物反应,请写出有关化学方程式___。
(5)②与Si元素分别形成的最高价氧化物,___的熔点更高,原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,当下列条件不再改变时,表明反应:A(s)+2B(g) ![]() C(g)+D(g)已达到平衡状态的是
C(g)+D(g)已达到平衡状态的是
A. 混合气体的压强 B. 气体的总物质的量
C. 混合气体的密度 D. 单位时间内生成n molC的同时消耗2n molB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知难溶性物质K2SO4·MgSO4·2CaSO4在水中存在如下平衡: K2SO4·MgSO4·2CaSO4(s)![]() 2Ca2+(aq)+2K+(aq)+Mg2+(aq)+4SO42- (aq),不同温度下,K+的浸出浓度与溶浸时间的关系如图所示。则下列说法错误的是
2Ca2+(aq)+2K+(aq)+Mg2+(aq)+4SO42- (aq),不同温度下,K+的浸出浓度与溶浸时间的关系如图所示。则下列说法错误的是

A. 向该体系中分别加入饱和NaOH溶液和饱和碳酸钠溶液,沉淀溶解平衡均向右移动
B. 分析可知T1>T2>T3
C. 升高温度,溶浸速率增大,平衡向右移动
D. 该物质的Ksp=c2(Ca2+)·c2(K+)·c(Mg2+)·c4(SO42-)/c(K2SO4·MgSO4·2CaSO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置.下列叙述不正确的是
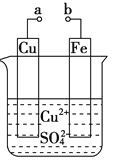
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解
D. a和b用导线连接后,Fe片上发生还原反应,溶液中的Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
A.NH4Cl![]() NH3↑+HCl↑B.2Na2O2+2CO2=2Na2CO3+O2
NH3↑+HCl↑B.2Na2O2+2CO2=2Na2CO3+O2
C.2NaOH+Cl2=NaCl+NaClO+H2OD.NH3+CO2+H2O=NH4HCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装 置的开关时,观察到电流表的指针发生了偏转。
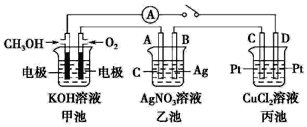
请回答下列问题:
(1)甲池为原电池,通入 CH3OH 电极的电极反应为________。
(2)乙池中A(石墨)电极的名称为_____(填“正极”“负极”或“阴极”“阳极”),总反应为_____。
(3)当乙池B极质量增加 5.4 g 时,甲池中理论上消耗 O2 的体积为_____mL(标准状况),丙池D极析出_____g 铜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,22.4LSO3含有NA个分子
B.1molNaHSO4溶于水后电离出的离子数目为2NA
C.标准状况下,2.24LN2和O2的混合气体中分子数为0.1NA
D.0.1mol·L-1的Ba(OH)2溶液中含有的OH-数目为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com