
(7分)(1)中国古代四大发明之一——黑火药,它的爆炸反应为:
2KNO3+ 3C+S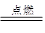 A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
①除 S 外,上列元素的电负性从大到小依次为_________________________;
②生成物中,A 的电子式为__________________,含极性共价键的分子的中心原子轨道杂化类型____________;
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为____________。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布式为_______________________________,Q2+的未成对电子数是________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
(7分) (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示_________,K值大小与温度的关系是:温度升高,K值________(填增大、减小、可能增大也可能减小)。
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)十H2O(g) CO2(g)十H2 (g) △H<0。CO和H2O浓度变化如下右图,则 0—4min的平均反应速率v(CO)=______mol/(L·min)
t1℃时物质浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 |
|
| 6 | 0.096 | 0.266 | 0.104 |
|
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上左表。
①表中3min—4min之间反应处于_________状态; C1数值_________0.08 mol/L (填大于、小于或等于)。
②反应在4min—5min之间,平衡向逆方向移动,可能的原因是________(单选),表中5min—6min之间数值发生变化,可能的原因是__________(单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省昭觉中学高二10月月考化学试卷(带解析) 题型:填空题
(1)中国古代四大发明之一——黑火药,它的爆炸反应为:
2KNO3+ 3C+S A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
① 除 S 外,上列元素的电负性从大到小依次为_________________________;
②生成物中,A 的电子式为__________________ ,含极性共价键的分子的中心原子轨道杂化类型____________;
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为____________。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布式为_______________________________,Q2+的未成对电子数是________。
查看答案和解析>>
科目:高中化学 来源:2014届四川省高二10月月考化学试卷(解析版) 题型:填空题
(1)中国古代四大发明之一——黑火药,它的爆炸反应为:
2KNO3+ 3C+S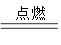 A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
① 除 S 外,上列元素的电负性从大到小依次为_________________________;
②生成物中,A 的电子式为__________________ ,含极性共价键的分子的中心原子轨道杂化类型____________;
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为____________。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布式为_______________________________,Q2+的未成对电子数是________。
查看答案和解析>>
科目:高中化学 来源:2014届四川省高二10月阶段性考试化学试卷(解析版) 题型:填空题
(7分)(1)中国古代四大发明之一——黑火药,它的爆炸反应为:
2KNO3+ 3C+S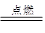 A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
①除 S 外,上列元素的电负性从大到小依次为_________________________;
②生成物中,A 的电子式为__________________,含极性共价键的分子的中心原子轨道杂化类型____________;
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为____________。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布式为_______________________________,Q2+的未成对电子数是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com