
【题目】NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
(1)用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(l)![]() HNO3(aq)+HNO2(aq) ΔH=116.1 kJ·mol1
HNO3(aq)+HNO2(aq) ΔH=116.1 kJ·mol1
3HNO2(aq)![]() HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol1
HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol1
反应3NO2(g)+H2O(l)![]() 2HNO3(aq)+NO(g)的ΔH=___________kJ·mol1。
2HNO3(aq)+NO(g)的ΔH=___________kJ·mol1。
(2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:____________________________________。
(3)用酸性(NH2)2CO水溶液吸收NOx,吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。写出该反应的化学方程式:____________________________________。
(4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成1 mol N2时,转移的电子数为__________mol。
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见题20图1)。

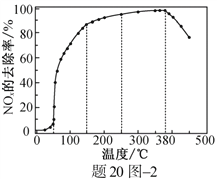
反应相同时间NOx的去除率随反应温度的变化曲线如题20图2所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是____________________________;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是___________________________。
【答案】(14分)
(1)136.2
(2)HNO22e+H2O![]() 3H++NO3
3H++NO3
(3)2HNO2+(NH2)2CO![]() 2N2↑+CO2↑+3H2O
2N2↑+CO2↑+3H2O
(4)①![]()
②迅速上升段是催化剂活性随温度升高增大与温度升高共同使NOx去除反应速率迅速增大;上升缓慢段主要是温度升高引起的NOx去除反应速率增大
催化剂活性下降;NH3与O2反应生成了NO
【解析】分析:(1)应用盖斯定律解答。
(2)根据电解原理,阳极发生失电子的氧化反应,阳极反应为HNO2失去电子生成HNO3。
(3)HNO2与(NH2)2CO反应生成N2和CO2,根据得失电子守恒和原子守恒写出方程式。
(4)①NH3与NO2的反应为8NH3+6NO2![]() 7N2+12H2O,该反应中NH3中-3价的N升至0价,NO2中+4价的N降至0价,生成7molN2转移24mol电子。
7N2+12H2O,该反应中NH3中-3价的N升至0价,NO2中+4价的N降至0价,生成7molN2转移24mol电子。
②因为反应时间相同,所以低温时主要考虑温度和催化剂对化学反应速率的影响;高温时NH3与O2发生催化氧化反应生成NO。
详解:(1)将两个热化学方程式编号,
2NO2(g)+H2O(l)=HNO3(aq)+HNO2(aq) ΔH=116.1 kJ·mol1(①式)
3HNO2(aq)=HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol1(②式)
应用盖斯定律,将(①式![]() 3+②式)
3+②式)![]() 2得,反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)ΔH=[(116.1 kJ·mol1)
2得,反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)ΔH=[(116.1 kJ·mol1)![]() 3+75.9 kJ·mol1]
3+75.9 kJ·mol1]![]() 2=-136.2kJ·mol1。
2=-136.2kJ·mol1。
(2)根据电解原理,阳极发生失电子的氧化反应,阳极反应为HNO2失去电子生成HNO3,1molHNO2反应失去2mol电子,结合原子守恒和溶液呈酸性,电解时阳极电极反应式为HNO2-2e-+H2O=NO3-+3H+。
(3)HNO2与(NH2)2CO反应生成N2和CO2,N元素的化合价由HNO2中+3价降至0价,N元素的化合价由(NH2)2CO中-3价价升至0价,根据得失电子守恒和原子守恒,反应的化学方程式为2HNO2+(NH2)2CO=2N2↑+CO2↑+3H2O。
(4)①NH3与NO2的反应为8NH3+6NO2![]() 7N2+12H2O,该反应中NH3中-3价的N升至0价,NO2中+4价的N降至0价,生成7molN2转移24mol电子。生成1molN2时转移电子数为
7N2+12H2O,该反应中NH3中-3价的N升至0价,NO2中+4价的N降至0价,生成7molN2转移24mol电子。生成1molN2时转移电子数为![]() mol。
mol。
②因为反应时间相同,所以低温时主要考虑温度和催化剂对化学反应速率的影响;高温时NH3与O2发生催化氧化反应。在50~250℃范围内,NOx的去除率迅速上升段是催化剂活性随温度升高增大与温度升高共同使NOx去除反应速率迅速增大;上升缓慢段主要是温度升高引起的NOx去除反应速率增大,温度升高催化剂活性下降。反应温度高于380℃时,NOx的去除率迅速下降的原因可能是NH![]() 4NO+6H2O。
4NO+6H2O。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】有关下列装置或操作说法错误的是
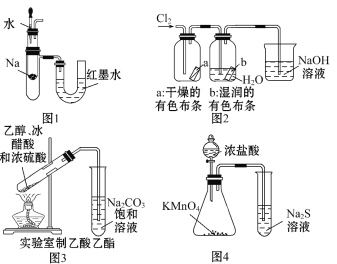
A. 图1中:将胶头滴管中的水滴入到金属钠中,能看到U形管右侧红墨水高度不变
B. 图2中:观察到湿润的有色布条能褪色,待尾气全部被碱吸收后,将稀硫酸滴入烧杯中,至溶液显酸性,可能看到有黄绿色气体生成
C. 图3可用于制备乙酸乙酯
D. 图4可以比较KMnO4、Cl2和S氧化性的相对强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物环丙叉环丙烷,由于其特殊的电导结构一直受到理论化学家的注意,其结构如图所示。有关它的说法中错误的是( )
![]()
A. 其二氯代物有4种 B. 它所有的原子均在同一平面上
C. 其分子式为C6H8 D. 它不可能是环丙烷的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性。回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式____________________ 。
(2)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①H3PO2中,P元素的化合价为 _____________。
②NaH2PO2为________(填 “正盐”或“酸式盐”),其溶液显______(填“弱酸性”、 “中性”或“弱碱性”)。
③利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产 物为_____(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.萃取分液法 B.加热分解 C.结晶法 D.分液法 E.渗析法 F.蒸馏法 G.过滤法
(1)___________分离水和煤油的混合物。
(2)___________分离水和酒精。
(3)___________分离溴水中的溴和水。
Ⅱ、欲用98%的浓硫酸(g=1.84g/cm3)配制浓度为0.5mol/L的稀硫酸480ml。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平⑦药匙。
请回答下列问题:
(4)上述仪器中,在配制稀H2SO4时不需要使用的有___________(填代号),还缺少的仪器是______________________;
(5)经计算,需浓H2SO4的体积为___________;如果实验室有15mL、20mL、50mL的量筒应选用_______mL的量筒最好,量取时俯视量筒读数将使浓度__________(“偏高”、“偏低”、“无影响”);
(6)将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌的目的是____________,若未冷却至室温便将溶液转移至容量瓶会使浓度偏________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com