
【题目】下图为某化工企业生产流程示意图,下列说法正确的是( )
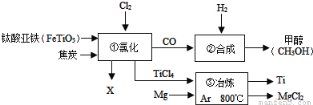
A. 钛酸亚铁(FeTiO3)中钛元素为+3价
B. ①中反应为:2FeTiO3+6C+7Cl2==== 2X+2TiCl4+6CO,则X为FeCl3
C. ③中氩气(Ar)作反应物,反应类型为置换反应
D. ②中为使原料全部转化为甲醇,理论上CO和H2投料的质量比为1:2
【答案】B
【解析】
A项,根据在化合物中正负化合价代数和为零考虑;B项,根据质量守恒定律推断x的化学式;C项,氩气(Ar)为惰性气体,防止金属钛被氧化,根据镁与四氯化钛反应的生成物判断反应类型;D项,根据氢气和一氧化碳反应的方程式考虑质量比。
A项,设FeTiO3中Ti的化合价是x,FeTiO3中Fe的化合价是+2价,O的化合价是-2价,利用化合物中各元素的化合价的代数和为零的原则得到:2+x+(-2)×3=0,计算得出 x=+4,所以钛酸亚铁FeTiO3中钛元素的化合价是+4价,故A错误;B项,根据质量守恒定律,在反应前后各元素原子的个数不变,从2FeTiO3+6C+7Cl2== 2X+2TiCl4+6CO中看钛原子、氧原子、碳原子反应前后除物质x外个数已经相等,故x中无钛原子、氧原子、碳原子,铁反应前共有2个,反应后只有x有,所以2x中有2个,从而x中有1个,氯原子反应前有14个,反应后x除外有8个,所以2x中有6个;因此x中有3个,因此x的化学式是FeCl3,故B项正确;C项,TiCl4与Mg反应的反应物是TiCl4与Mg,生成物是Ti和MgCl2,因此该反应的化学方程式是![]() ,该反应是单质和化合物反应生成另外的单质和化合物,属于置换反应,而氩气(Ar)为惰性气体,不参与反应,起到保护气的作用,故C错误;D项,根据从化学方程式2H2+CO=CH3OH可知,4g H2参加反应,消耗28gCO,由此可以知道一氧化碳和氢气的质量比是:28:4=7:1,故D错误;正确选项B。
,该反应是单质和化合物反应生成另外的单质和化合物,属于置换反应,而氩气(Ar)为惰性气体,不参与反应,起到保护气的作用,故C错误;D项,根据从化学方程式2H2+CO=CH3OH可知,4g H2参加反应,消耗28gCO,由此可以知道一氧化碳和氢气的质量比是:28:4=7:1,故D错误;正确选项B。


科目:高中化学 来源: 题型:
【题目】主族元素在周期表中的位置,取决于该元素的( )
A.最外层电子数和相对原子质量
B.相对原子质量和核外电子数
C.次外层电子数和电子层数
D.电子层数和最外层电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沉淀的生成、溶解和转化在无机物制备和提纯以及科研等领域有广泛应用。
Ⅰ.汽车尾气中的SO2可用石灰水来吸收,生成CaSO3浊液。已知常温下Ka1(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9 常温下测得某纯CaSO3与水形成的浊液pH=9,忽略SO32-的第二步水解,则Ksp(CaSO3)=__________ 。CaSO3易变质为CaSO4,水垢中含有较多的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。CaSO4转化为CaCO3的离子方程式为:_________;
Ⅱ.已知25℃时,NH3H2O电离常数Kb=1.8×10-5,Ksp[Mg(OH)2]=1.0×10-11,向0.4mol/L的氨水中加入等体积浓度为6×10-4mol/L MgCl2 溶液,________沉淀生成(填“无”或“有”),并简述理由______;若某溶液中C(Mg2+)=1.2×10-3mol/L,需向其中加入等体积的NaOH溶液浓度为_____ mol/L时,可使Mg2+恰好沉淀完全(忽略溶液体积变化)。
Ⅲ.工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3
Cr(OH)3
其中第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
①若平衡体系的pH=2,则溶液显____________色。
②能说明第①步反应达平衡状态的是_____________。
A.Cr2O72-和CrO42-的浓度相同 B.2v (Cr2O72-) =v (CrO42-) C.溶液的颜色不变
③第②步中,还原1mol Cr2O72-离子,需要________mol的FeSO4·7H2O。
④第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+ (aq)+3OH-(aq) 常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至__________。
Cr3+ (aq)+3OH-(aq) 常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲乙是某同学设计的两套制取二氧化碳的发生装置,对两套装置分析正确的是

A. 此时甲装置中的止水夹M处于打开状态
B. 甲装置气体导出过程中容器内外气压相等
C. 甲装置不具有启普发生器的功能
D. 乙装置N处添加止水夹可以与甲装置具有相同功能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)画出下列元素的原子结构示意图。
①核电荷数为13的元素:__________。
②某元素原子的最外层电子数等于次外层电子数:__________________ 。
③L 层电子数是M层电子数2倍的元素: ___________________ 。
④某同位素原子核内没有中子的元素: ___________________ 。
(2)写出1~18号元素中符合下列条件的原子(离子)的微粒符号和结构示意图。
①某元素原子L层上的电子数为K层的3倍: __________________ 。
②某元素原子L层上的电子数为K层的一半: _________________ 。
③得到2个电子后,电子总数与氩原子的电子总数相同的离子: ___________________ 。
④某元素原子的最外层电子数等于次外层电子数的2倍: ___________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以用离子方程式2H++CO32﹣=H2O+CO2↑来表示的化学反应是( )
A.硝酸和碳酸氢钠溶液的反应
B.稀硫酸和碳酸钾溶液的反应
C.醋酸和碳酸钠溶液的反应
D.盐酸和碳酸钡溶液的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于处于化学平衡状态的反应C(s)+H2O(g)=CO(g)+H2(g) △H>0,既要提高反应速率又要提高H2O的转化率,下列措施中可行的是
A. 升高温度 B. 使用合适的催化剂
C. 增大体系压强 D. 增大H2O(g)的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中错误的是 ( )
A.原子半径:Cl>S>OB.还原性:Na>Mg>Al
C.稳定性:HF>HCl>HBrD.酸性:HClO4>H2SO4>H3PO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com