
【题目】(1)已知25℃、101 kPa时:
①2SO2(g)+O2(g)2SO3(g) ΔH1=-197 kJ/mol;
②H2O(g)=H2O(l) ΔH2=-44 kJ/mol;
③2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) ΔH3=-545 kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式为__________。
(2)已知:温度过高时,WO2(s)转变为WO2(g):
①WO2(s)+2H2(g)W(s)+2H2O(g) ΔH1=+66.0 kJ·mol-1
②WO2(g)+2H2(g)W(s)+2H2O(g) ΔH2=-137.9 kJ·mol-1
则WO2(s)WO2(g)的ΔH=__________。
【答案】SO3 (g)+H2O(l)=H2SO4(l) △H=-130kJ/mol +203.9 kJmol-1
【解析】
(1)2SO2(g)+O2(g)=2SO3(g)△H1=-197kJ/mol ①
H2O (g)=H2O(1)△H2=-44kJ/mol ②
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=-545kJ/mol③
利用盖斯定律:(③-①)×![]() -②得SO3 (g)+H2O(l)=H2SO4(l)△H=-130kJ/mol;
-②得SO3 (g)+H2O(l)=H2SO4(l)△H=-130kJ/mol;
(2)已知:①WO2 (s)+2H2 (g)W (s)+2H2O (g);△H=+66.0kJmol-1
②WO2 (g)+2H2W (s)+2H2O (g);△H=-137.9kJmol-1
①-②得则WO2 (s)WO2 (g),故△H=66.0kJmol-1-(-137.9kJmol-1)=+203.9 kJmol-1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】醇与氢卤酸的反应是制备卤代烃的重要方法,实验室制备溴乙烷和1—溴丁烷的反应如下:NaBr+H2SO4(浓)=HBr+NaHSO4R-OH+HBr→R-Br+H2O
可能存在的副反应有:醇在浓硫酸的作用下脱水生成烯烃和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下:
乙醇 | 溴乙烷 | 正丁醇 | 1—溴丁烷 | |
密度/g.cm-3 | 0.79 | 1.46 | 0.81 | 1.28 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
请回答下列问题:
(1)溴乙烷和1—溴丁烷的制备过程中,下列仪器最不可能用到的是(______)
A.圆底烧瓶 B.量筒 C.锥形瓶 D.漏斗
(2)卤代烃的水溶性__(填“大于”、“小于”或者“等于”)相应的醇,其原因是__。
(3)将溴乙烷粗产品置于分液漏斗中加水,震荡后静置,产品在__(填“上层”、“下层”或者“不分层”)。
(4)在制备溴乙烷时,乙醇会在浓硫酸的作用下脱水生成醚,写出此反应的化学方程式__。
(5)制备操作中,加入的浓硫酸必须稀释,其原因是(______)
A.减少副产物烯烃和醚的生成 B.减少Br2的生成
C.减少HBr的挥发 D.水是反应的催化剂
(6)欲除去卤代烃中的少量杂质Br2,下列物质中最适合的是(______)
A.NaI B.NaOH C.NaHSO3 D.KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香烃A是基本有机化工原料,由A制备高分子E和医药中间体K的合成路线(部分反应条件略去)如下图所示:
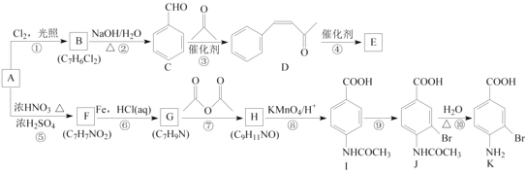
己知:①![]() ;
;
②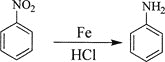
回答下列问题:
(1)A的名称是________,I含有官能团的名称是________。
(2)反应⑦的作用是________,⑩的反应类型是________。
(3)写出反应②的化学方程式:____________________________________________________。
(4)D分子中最多有________个原子共平面。E的结构简式为________。
(5)写出一种同时符合下列条件的F的同分异构体的结构简式:________。
①苯环上只有两种不同化学环境的氢原子;
②既能与银氨溶液反应又能与NaOH溶液反应。
(6)将由D为起始原料制备![]() 的合成路线补充完整。
的合成路线补充完整。
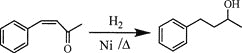 ________(无机试剂及溶剂任选)。
________(无机试剂及溶剂任选)。
合成路线流程图示例如下:
CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面的键线式表示维生素A的分子结构:
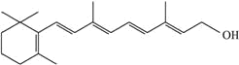
(1)维生素A分子式是_____。
(2)维生素A中氧的质量分数是____。
(3)维生素A的分子结构中含氧官能团的电子式是_____。
(4)关于维生素A的说法正确的是_____(填编号)。
①是一种酚
②属于芳香族化合物
③能与NaOH溶液反应
④能使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置有关说法错误的是

A. 装置Ⅰ:可以用来验证碳的非金属性比硅强
B. 装置Ⅱ:可以用来比较Na2CO3和NaHCO3的热稳定性
C. 装置Ⅲ:先从①口进气收集满二氧化碳,再从②口进气,可收集NO气体
D. 装置Ⅳ:制备Fe(OH)2并能保证较长时间观察到白色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制450mL 0.2mol / L 的 NaOH 溶液,实验操作步骤有:
A 用托盘天平称一定量的 NaOH 固体,用适量的蒸馏水使它完全溶解;
B 把溶解得到的溶液立即小心地转移到容量瓶中;
C 继续向容量瓶中加蒸馏水至液面距刻度线1 ~ 2cm 处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低处与刻度线相切;
D 用少量蒸馏水洗涤烧杯和玻璃棒2~ 3 次,每次的洗涤液都小心注入容量瓶,并轻轻振荡;
E 将容量瓶瓶塞塞紧,反复上下颠倒充分摇匀。请填写下列空白:
(1)上述操作步骤的正确顺序为(填序号)____________。
(2)需称量_____g 的 NaOH 固体:有错误的操作步骤是_____(填序号)。
(3)下列情况会使本实验所配溶液浓度偏高的是_____(填序号)。
A 在溶解搅拌时,有液体溅出;
B 将 NaOH 放在纸张上称量;
C NaOH 在烧杯中溶解后,立即转移到容量瓶中;
D 用带游码的托盘天平称 NaOH 时误用了“左码右物”的方法;
E 定容时仰视刻度线;
F 容量瓶未干燥就用来转移溶液;
G 摇匀后发现液面低于容量瓶刻度线;
H 加蒸馏水时,不慎超过了刻度线。
(4)本实验需要用到的多种仪器,除了烧杯、托盘天平一套、玻璃棒外,要完成该实验还缺少的仪器是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用50 mL 0.50 mol·L-1的盐酸与50mL 0.55 mol·L-1的氢氧化钠溶液在如图所示的装置中进行中和反应,测定反应过程中所放出的热量并计算每生成1 mol液态水时放出的热量。
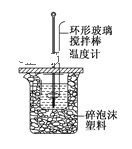
完成下列问题:
①烧杯间填满碎泡沫塑料的作用是__________。
②用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的生成1 mol液态水时放出热量的数值会__________。
(2)现有反应PCl5(g)PCl3(g)+Cl2(g),523K时,将10mol PCl5注入容积为2L的密闭容器中,平衡时压强为原来的1.5倍。
①该温度下该反应的平衡常数K为__________
②PCl5的平衡转化率为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是( )
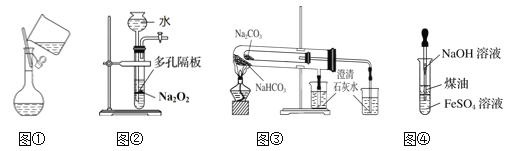
A. 图①向容量瓶中转移溶液
B. 图②用于Na2O2和H2O反应制取少量的O2
C. 图③比较碳酸钠和碳酸氢钠的热稳定性
D. 图④制备Fe(OH)2并能较长时间观察到白色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用示意图或图示的方法能够直观形象地将化学知识传授给学生,下列示意图或图示正确的是( )
A.砷原子的结构示意图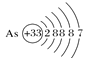 B.BF4—的结构式
B.BF4—的结构式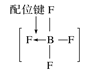
C.HF分子间的氢键 D.丙氨酸的手性异构
D.丙氨酸的手性异构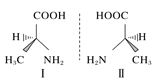
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com