
【题目】醇与氢卤酸的反应是制备卤代烃的重要方法,实验室制备溴乙烷和1—溴丁烷的反应如下:NaBr+H2SO4(浓)=HBr+NaHSO4R-OH+HBr→R-Br+H2O
可能存在的副反应有:醇在浓硫酸的作用下脱水生成烯烃和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下:
乙醇 | 溴乙烷 | 正丁醇 | 1—溴丁烷 | |
密度/g.cm-3 | 0.79 | 1.46 | 0.81 | 1.28 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
请回答下列问题:
(1)溴乙烷和1—溴丁烷的制备过程中,下列仪器最不可能用到的是(______)
A.圆底烧瓶 B.量筒 C.锥形瓶 D.漏斗
(2)卤代烃的水溶性__(填“大于”、“小于”或者“等于”)相应的醇,其原因是__。
(3)将溴乙烷粗产品置于分液漏斗中加水,震荡后静置,产品在__(填“上层”、“下层”或者“不分层”)。
(4)在制备溴乙烷时,乙醇会在浓硫酸的作用下脱水生成醚,写出此反应的化学方程式__。
(5)制备操作中,加入的浓硫酸必须稀释,其原因是(______)
A.减少副产物烯烃和醚的生成 B.减少Br2的生成
C.减少HBr的挥发 D.水是反应的催化剂
(6)欲除去卤代烃中的少量杂质Br2,下列物质中最适合的是(______)
A.NaI B.NaOH C.NaHSO3 D.KCl
【答案】D 小于 醇分子和水分子间可形成氢键,卤代烃分子和水分子间不能形成氢键 下层 2CH3CH2OH ![]() CH3CH2OCH2CH3+H2O ABC C
CH3CH2OCH2CH3+H2O ABC C
【解析】
(1)过滤操作时用到漏斗,故在溴乙烷和1—溴丁烷的制备实验中,最不可能用到的仪器
是漏斗;
(2)醇分子中含有羟基,醇与水分子之间可以形成氢键,故醇易溶于水;
(3)溴乙烷与水互不相溶,并且溴乙烷的密度比水的密度大;
(4)在制备溴乙烷时,乙醇会在浓硫酸的作用下,乙醇分子间脱水生成乙醚;
(5)浓硫酸具有强氧化性,能把Br-氧化成Br2;浓硫酸具有脱水性和吸水性,一定温度下,乙醇在浓硫酸的作用下能发生消去反应,浓硫酸溶解在溶液中放出大量的热,容易使溴化氢挥发;
(6)根据卤代烃在碱性溶液中水解,NaI和Br2反应生成I2,KCl与Br2不反应。
(1)A.圆底烧瓶可作为反应容器,是可用到的仪器,A不符合题意;
B.量筒可用来量取反应物,是可用到的仪器,B不符合题意;
C.锥形瓶可作为反应容器,是可用到的仪器,C不符合题意;
D.实验中无需过滤,所以最不可用到的仪器是漏斗, D符合题意;
答案选D;
(2)醇是能和水分子间形成氢键的物质而易溶于水,卤代烃和水不反应也不能和水形成氢键,所以卤代烃的水溶性小于相应的醇;
(3)溴乙烷与水互不相溶,并且溴乙烷的密度比水的密度大,所以将溴乙烷粗产品置于分液漏斗中加水,震荡后静置,产品在下层;
(4)在制备溴乙烷时,乙醇会在浓硫酸的作用下,乙醇分子间脱水生成乙醚,反应方程式为2CH3CH2OH ![]() CH3CH2OCH2CH3+H2O;
CH3CH2OCH2CH3+H2O;
(5)A.醇在浓硫酸作用下发生副反应,发生消去反应生成烯烃、分子间脱水生成醚,稀释后不能发生类似的反应,减少副产物烯烃和醚的生成,A正确;
B.浓硫酸具有强氧化性,能把Br-氧化成Br2,稀释浓硫酸后能减少Br2的生成,B正确;
C.反应需要溴化氢和乙醇或1—丁醇反应,浓硫酸溶解温度升高,使溴化氢挥发,稀释后减少溴化氢的挥发,C正确;
D.水是产物,不是催化剂,D错误;
答案选ABC;
(6)A.NaI和Br2反应生成I2,但生成的I2会混入卤代烃中,A不适合;
B.Br2和NaOH反应,卤代烃在氢氧化钠溶液中发生水解,B不适合;
C.Br2和NaHSO3溶液发生氧化还原反应,可以除去Br2,C适合;
D.KCl不能除去Br2,D不适合;
答案选C。


科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是( )
A.2SO2+O2=2SO3 ΔH=-196.6kJ·mol-1
B.H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8kJ
O2(g)=H2O(l) ΔH=-285.8kJ
C.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
D.C(s)+O2(g)=CO2(g) ΔH=393.5kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或操作正确的是
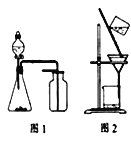
A.用广泛pH试纸测得0.1 molL-1 NH4Cl溶液的pH=5.2
B.选择合适的试剂,用图1装置可分别制取和收集少量CO2、NO
C.除去石英(主要成分SiO2)中少量碳酸钙:用稀盐酸溶解后用图2装置过滤
D.洗涤沉淀时(见图2),向漏斗中加适量水,搅拌并滤干
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗进行综合利用,不仅可以提高经济效益,而且还能防止环境污染。现按下列方式进行综合利用,回答问题。
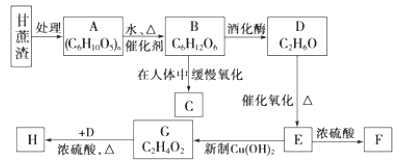
已知F、H均是具有香味的液体,F为E的三聚合物,并具有特殊的6元环状对称结构。
(1)A的名称_______________;H的名称______________;
(2)D→E的化学反应方程式______________________________;
(3)G→H的化学反应方程式_______________________________;
(4)E→ G的反应类型________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石主要成分为Cu(OH)2CO3,还含有少量Fe2O3、SiO2等杂质。某学习小组探究孔雀石综合利用的流程如下:
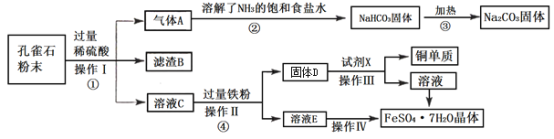
回答下列问题:
(1)步骤①中将孔雀石磨成粉末的目的是________________;操作I需要用到的玻璃仪器有________________。
(2)滤渣B的主要成分为_______;溶液C中的溶质有:CuSO4、________________。
(3)步骤②中发生反应的化学方程式为________________
(4)试剂X为________________;操作IV的步骤为________________、________________、过滤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列有关叙述不正确的是
A.0.1molC3H6Cl2中化学键总数为NA
B.42g乙烯中含碳原子数为3NA
C.标准状况下,1L苯完全燃烧生成的气态产物的分子数为(6/22.4)NA
D.0.1mol乙醇完全燃烧所消耗的氧气为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:mA(g)+nB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为________热反应,且m+n______p(填“>”、“=”或“<”)。
(2)减压时,A的质量分数__________。(填“增大”、“减小”或“不变”,下同)
(3)若容积不变加入B,则A的转化率__________,B的转化率__________。
(4)若升高温度,则平衡时B、C的浓度之比![]() 将__________。
将__________。
(5)若加入催化剂,平衡时气体混合物的总物质的量__________。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色__________;而维持容器内压强不变,充入氖气时,混合物颜色__________。(填“变深”、“变浅”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知异丙苯的结构简式如下![]() ,下列说法错误的是( )
,下列说法错误的是( )
A.异丙苯的分子式为C9H12
B.异丙苯的沸点比苯高
C.异丙苯的和苯互为同系物
D.异丙苯分子中一定共线的碳原子数为4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知25℃、101 kPa时:
①2SO2(g)+O2(g)2SO3(g) ΔH1=-197 kJ/mol;
②H2O(g)=H2O(l) ΔH2=-44 kJ/mol;
③2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) ΔH3=-545 kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式为__________。
(2)已知:温度过高时,WO2(s)转变为WO2(g):
①WO2(s)+2H2(g)W(s)+2H2O(g) ΔH1=+66.0 kJ·mol-1
②WO2(g)+2H2(g)W(s)+2H2O(g) ΔH2=-137.9 kJ·mol-1
则WO2(s)WO2(g)的ΔH=__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com