
【题目】某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗进行综合利用,不仅可以提高经济效益,而且还能防止环境污染。现按下列方式进行综合利用,回答问题。
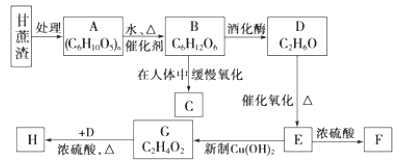
已知F、H均是具有香味的液体,F为E的三聚合物,并具有特殊的6元环状对称结构。
(1)A的名称_______________;H的名称______________;
(2)D→E的化学反应方程式______________________________;
(3)G→H的化学反应方程式_______________________________;
(4)E→ G的反应类型________________________________。
【答案】纤维素 乙酸乙酯 2CH3CH2OH + O2 ![]() 2CH3CHO + 2H2O CH3CH2OH +CH3COOH
2CH3CHO + 2H2O CH3CH2OH +CH3COOH![]() CH3COOCH2CH3 + H2O 氧化反应
CH3COOCH2CH3 + H2O 氧化反应
【解析】
甘蔗渣处理之后得到纤维素,纤维素水解的最终产物为葡萄糖,所以A是纤维素,B是葡萄糖,葡萄糖在酒化酶的作用下反应生成乙醇,则D是乙醇,D发生催化氧化生成E,E为CH3CHO,E进一步发生氧化反应生成G,G为CH3COOH,G与D发生酯化反应生成H,H为CH3COOCH2CH3,葡萄糖在人体内最终氧化得到二氧化碳与水,F为E的三聚合物,并具有特殊的6元环状对称结构,F为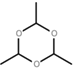 ,据此分析解答。
,据此分析解答。
(1)由上述分析可知,A为纤维素,H为CH3COOCH2CH3,名称为:乙酸乙酯,故答案为:纤维素;乙酸乙酯;
(2)D→E的化学方程式:2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2
2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
(3)G→H的化学方程式为:CH3CH2OH+CH3COOH ![]() CH3COOCH2CH3+H2O,故答案为:CH3CH2OH+CH3COOH
CH3COOCH2CH3+H2O,故答案为:CH3CH2OH+CH3COOH ![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(4)E→ G为乙醛与新制氢氧化铜悬浊液的反应,CH3CHO+2Cu(OH)2![]() CH3COOH+Cu2O↓+2H2O,属于氧化反应,故答案为:氧化反应。
CH3COOH+Cu2O↓+2H2O,属于氧化反应,故答案为:氧化反应。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是( )
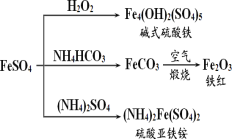
A.碱式硫酸铁水解能产生 Fe(OH)3 胶体,可用作净水剂
B.为防止 NH4HCO3 分解,生产 FeCO3 需在较低温度下进行
C.常温下,(NH4)2Fe(SO4)2 在水中的溶解度比 FeSO4 的大
D.可用 KSCN 溶液检验(NH4)2Fe(SO4)2 是否被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是
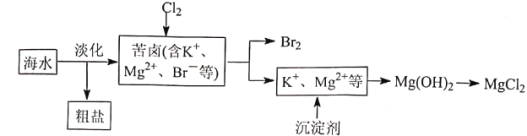
A.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等
B.苦卤中通入Cl2可以提取Br2,说明氯的非金属性强于溴
C.工业生产中沉淀剂常选用Ca(OH)2
D.工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分离提纯混合物的方法错误的是( )
A.选用裂化汽油作萃取剂从溴水中萃取溴单质
B.用重结晶法从硝酸钾和氯化钠的混合溶液中获得硝酸钾
C.分离甲苯(沸点为110.6℃)和四氯化碳(沸点为76.75℃)的混合物用蒸馏法
D.通过饱和食盐水除去混在氯气中的少量氯化氢气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。供选试剂:30%H2O2溶液、0.1 mol/L H2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如下(请补充完整甲组实验仪器的名称。)
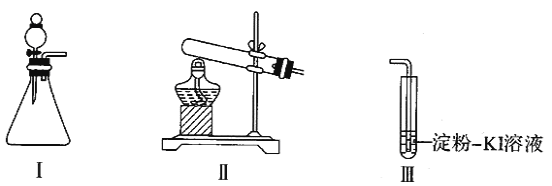
操 作 | 现 象 | |
甲 | 向Ⅰ的锥形瓶中加入MnO2,向Ⅰ的________中加入30%的H2O2溶液,连接Ⅰ、Ⅲ,打开活塞 | Ⅰ中产生无色气体并伴随大量的白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/LH2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式是__________________。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是____________。为进一步探究该条件对反应速率的影响,可采取的实验措施是____________。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列_____________(填字母)溶液,证明了白雾中含有H2O2。
A.酸性 KMnO4 B. FeCl2 C. Na2S D.品红
(5)资料显示:KI溶液在空气中久置会被缓慢氧化:4KI+O2 +2H2O=2I2 +4KOH。该小组同学取20ml久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是:3I2+6OH-=5I-+IO3-+3H2O造成的。请设计实验证明他们的猜想是否正确:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是
A. 用排水法收集铜粉与浓硝酸反应产生的NO2
B. 用氨水鉴别NaCl、MgCl2、AlCl3、NH4Cl四种溶液
C. 用酸性KMnO4溶液验证草酸的还原性
D. 用饱和NaHCO3溶液除去Cl2中混有的HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇与氢卤酸的反应是制备卤代烃的重要方法,实验室制备溴乙烷和1—溴丁烷的反应如下:NaBr+H2SO4(浓)=HBr+NaHSO4R-OH+HBr→R-Br+H2O
可能存在的副反应有:醇在浓硫酸的作用下脱水生成烯烃和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下:
乙醇 | 溴乙烷 | 正丁醇 | 1—溴丁烷 | |
密度/g.cm-3 | 0.79 | 1.46 | 0.81 | 1.28 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
请回答下列问题:
(1)溴乙烷和1—溴丁烷的制备过程中,下列仪器最不可能用到的是(______)
A.圆底烧瓶 B.量筒 C.锥形瓶 D.漏斗
(2)卤代烃的水溶性__(填“大于”、“小于”或者“等于”)相应的醇,其原因是__。
(3)将溴乙烷粗产品置于分液漏斗中加水,震荡后静置,产品在__(填“上层”、“下层”或者“不分层”)。
(4)在制备溴乙烷时,乙醇会在浓硫酸的作用下脱水生成醚,写出此反应的化学方程式__。
(5)制备操作中,加入的浓硫酸必须稀释,其原因是(______)
A.减少副产物烯烃和醚的生成 B.减少Br2的生成
C.减少HBr的挥发 D.水是反应的催化剂
(6)欲除去卤代烃中的少量杂质Br2,下列物质中最适合的是(______)
A.NaI B.NaOH C.NaHSO3 D.KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某(NH4)2CO3和(NH4)2SO4的固体混合物含氮量为23.3%。
(1)取9.0g该混合物,加入足量浓NaOH溶液,加热,产生的气体在标准状况下体积为________________L(保留2位小数)。
(2)向上述反应后的混合溶液中再加入足量稀盐酸,产生560mL气体(标准状况)。列式计算原固体混合物中(NH4)2CO3和(NH4)2SO4的物质的量之比。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面的键线式表示维生素A的分子结构:
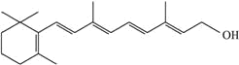
(1)维生素A分子式是_____。
(2)维生素A中氧的质量分数是____。
(3)维生素A的分子结构中含氧官能团的电子式是_____。
(4)关于维生素A的说法正确的是_____(填编号)。
①是一种酚
②属于芳香族化合物
③能与NaOH溶液反应
④能使溴水褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com