
【题目】下列热化学方程式书写正确的是( )
A.2SO2+O2=2SO3 ΔH=-196.6kJ·mol-1
B.H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8kJ
O2(g)=H2O(l) ΔH=-285.8kJ
C.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
D.C(s)+O2(g)=CO2(g) ΔH=393.5kJ·mol-1
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某同学对教材中探究分子性质的实验(图1)进行了改进,如图2所示,试管丙中有一张每隔1cm滴有一滴酚酞溶液的滤纸条,装有适量浓氨水的敞口小药瓶固定在橡皮塞上。关于图1图2中的实验有以下说法,其中正确的是( )
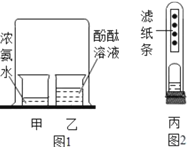
①图2比图1的实验减少了大气污染、更节约
②图1和图2的实验均能证明分子在不断运动
③图2中观察到的现象是滤纸条上的酚酞试液自上而下依次变红
④若另取与丙相同的装置浸入10℃的冷水中,则不能得出结论
A.①②B.①②④C.①②③④D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 NA 表示阿伏加德罗常数的值,下列说法中正确的是( )
①1mol Na2O 和 Na2O2 混合物中含有的阴、阳离子总数是 3NA
②常温常压下,92g的NO2和N2O4 混合气体含有的原子数为 6NA
③7.8 g![]() 中含有的碳碳双键数目为 0.3 NA
中含有的碳碳双键数目为 0.3 NA
④用 1L1.0 mol/LFeCl3 溶液制备氢氧化铁胶体,所得氢氧化铁胶粒的数目为 NA
⑤1mol SO2与足量O2在一定条件下充分反应生成 SO3,共转移 2NA个电子
⑥在反应 KIO3+6HI=KI+3I2+3H2O 中,每生成 3molI2 转移的电子数为 5NA
A.①②③B.②③④C.①②⑥D.④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是( )
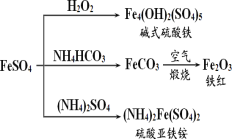
A.碱式硫酸铁水解能产生 Fe(OH)3 胶体,可用作净水剂
B.为防止 NH4HCO3 分解,生产 FeCO3 需在较低温度下进行
C.常温下,(NH4)2Fe(SO4)2 在水中的溶解度比 FeSO4 的大
D.可用 KSCN 溶液检验(NH4)2Fe(SO4)2 是否被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合金只含铝、铁、铜三种元素,取合金![]() ,加入到含
,加入到含![]() 稀硝酸的溶液中,恰好完全反应,放出无色气体11.2L(标准状况下)。将反应后的溶液分成2等份,向一份溶液中滴加
稀硝酸的溶液中,恰好完全反应,放出无色气体11.2L(标准状况下)。将反应后的溶液分成2等份,向一份溶液中滴加![]() ,无明显现象。向另一份溶液中滴加氨水至过量,过滤得沉淀bg,充分灼烧得固体cg,减轻了5.4g,再加入到过量的
,无明显现象。向另一份溶液中滴加氨水至过量,过滤得沉淀bg,充分灼烧得固体cg,减轻了5.4g,再加入到过量的![]() 溶液中,剩余不溶物dg。下列说法不正确的是
溶液中,剩余不溶物dg。下列说法不正确的是
已知;![]() 遇到
遇到![]() 会出现蓝色沉淀。
会出现蓝色沉淀。
A. ![]()
B. 原合金中铜的质量为![]()
C. 若将上述![]() 稀硝酸逐滴加入到合金中,放出气体仍为
稀硝酸逐滴加入到合金中,放出气体仍为![]() (标准状况下)
(标准状况下)
D. d不是一确定值,可能为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对复杂的有机物结构可用“键线式”表示。如苯丙烯酸1—丙烯酯: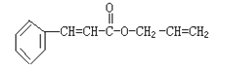 可简化为
可简化为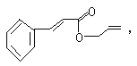 杀虫剂“阿乐丹”的结构表示为
杀虫剂“阿乐丹”的结构表示为 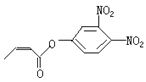 ,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )
,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )
A.遇FeCl3溶液均显紫色B.均能发生银镜反应
C.均能与溴水发生反应D.均能与NaOH溶液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计用如图所示实验装置(夹持仪器省略)制取干燥的氨气并验证NH3具有还原性,请回答下列问题:
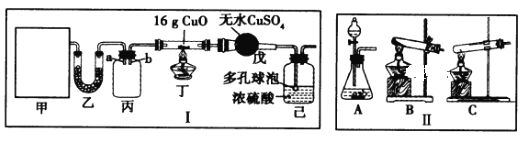
(1)实验室制备氨气有多种方法,现欲用NH4C1与Ca(OH)2反应制取NH3,则甲中的气体发生装置___________(从Ⅱ中选用);用浓氨水与生石灰反应也可制取NH3,反应的化学方程式为__________
(2)装置丙用于收集NH3,应将导管__________(填“a”或“b”)延长至集气瓶底部,装置乙中盛放的试剂为__________,装置己的作用为____________(答两点)。
(3)若装置丁中黑色固体变红,则装置戊中现象为_________
(4)研究小组的同学通过讨论、分析后认为充分反应后生成的红色固体可能是Cu或Cu2O或二者的混合物,通过查阅资料知:Cu2O+2H+=Cu+Cu2++H2O。为探究固体的成分,提出了如下两种方案。
I. 甲同学取少量红色固体与稀硝酸混合,最终得到蓝色溶液,由此推测红色产物中有Cu2O。
①你对甲同学实验设计的评价是__________(请给出必要的文字解释)。
②Cu2O与稀硝酸反应的离子方程式为_____________
Ⅱ.乙同学认为不需要借助任何化学试剂,只需要称量生成的红色固体的质量(设为xg)就能确定产物成分,当x取值范围为 _____时,表明产物中既有Cu,又有Cu2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是
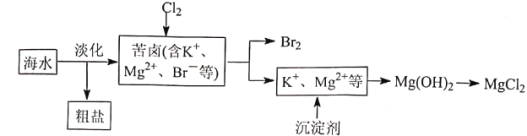
A.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等
B.苦卤中通入Cl2可以提取Br2,说明氯的非金属性强于溴
C.工业生产中沉淀剂常选用Ca(OH)2
D.工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇与氢卤酸的反应是制备卤代烃的重要方法,实验室制备溴乙烷和1—溴丁烷的反应如下:NaBr+H2SO4(浓)=HBr+NaHSO4R-OH+HBr→R-Br+H2O
可能存在的副反应有:醇在浓硫酸的作用下脱水生成烯烃和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下:
乙醇 | 溴乙烷 | 正丁醇 | 1—溴丁烷 | |
密度/g.cm-3 | 0.79 | 1.46 | 0.81 | 1.28 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
请回答下列问题:
(1)溴乙烷和1—溴丁烷的制备过程中,下列仪器最不可能用到的是(______)
A.圆底烧瓶 B.量筒 C.锥形瓶 D.漏斗
(2)卤代烃的水溶性__(填“大于”、“小于”或者“等于”)相应的醇,其原因是__。
(3)将溴乙烷粗产品置于分液漏斗中加水,震荡后静置,产品在__(填“上层”、“下层”或者“不分层”)。
(4)在制备溴乙烷时,乙醇会在浓硫酸的作用下脱水生成醚,写出此反应的化学方程式__。
(5)制备操作中,加入的浓硫酸必须稀释,其原因是(______)
A.减少副产物烯烃和醚的生成 B.减少Br2的生成
C.减少HBr的挥发 D.水是反应的催化剂
(6)欲除去卤代烃中的少量杂质Br2,下列物质中最适合的是(______)
A.NaI B.NaOH C.NaHSO3 D.KCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com