

分析 A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,能与红热的铜丝反应得到D,能与Na反应,能与乙酸反应,A含有羟基,故A为CH3CH2OH,则C为CH3COOCH2CH3,D为CH3CHO,CH3CH2OH燃烧生成二氧化碳与水,CH3CH2OH与Na反应生成CH3CH2ONa与氢气,以此解答该题.
解答 解:A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,能与红热的铜丝反应得到D,能与Na反应,能与乙酸反应,A含有羟基,故A为CH3CH2OH,则C为CH3COOCH2CH3,D为CH3CHO,CH3CH2OH燃烧生成二氧化碳与水,CH3CH2OH与Na反应生成CH3CH2ONa与氢气,
(1)A为乙醇,含有的官能团为羟基,故答案为:乙醇;羟基;
(2)反应①为2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;
反应③为CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;
反应④是乙醇催化氧化生成乙醛,反应方程式为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
点评 本题考查有机物的推断,为高频考点,侧重于学生的分析能力的考查,明确乙醇的性质是解答本题的关键,注意图中反应条件及物质的性质的关系即可解答,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | Na2O2与H2O反应产生O2:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| B. | 用氢氧化钠溶液去除铝条表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O | |
| C. | 向铜片中滴加浓硫酸并加热,有刺激性气味气体产生:Cu+4H++SO42- $\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O | |
| D. | 向明矾溶液中滴入少量氢氧化钡溶液:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA | |
| B. | 由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 | |
| C. | 1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA个 | |
| D. | 60g二氧化硅中含有的共价键数为2NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ①②③④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某科研机构用NaOH溶液吸收硫酸工业废气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到某种副产物,其原理如图所示(电极材料为石墨).
某科研机构用NaOH溶液吸收硫酸工业废气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到某种副产物,其原理如图所示(电极材料为石墨).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
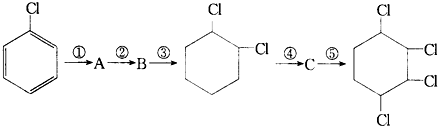
 B
B
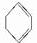 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 海水密度(g/mL) | CaSO4 | NaCl | MgCl2 | Mg SO4 | NaBr |
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
| A. | CaSO4 | B. | MgSO4 | C. | NaCl | D. | MgCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com