
����Ŀ��������Զ�������г���Ӧ��ԭ���ԭ���Ĵ���������ͼΪ��صĹ���ʾ��ͼ��������ɢ���봫�����������е缫�Ϸ�����Ӧ���������ͻ���յ����źţ��±��г��˴������弰���е缫�ϲ��ַ�Ӧ���
�������� | ���ֵ缫��Ӧ���� |
NO2 | NO |
Cl2 | HCl |
CO | CO2 |
H2S | H2SO4 |
������˵������ȷ���ǣ� ��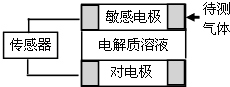
A.����������ʱ�����е缫�����������
B.���Cl2����ʱ�����е缫�ĵ缫��ӦΪ��Cl2+2e���T2Cl��
C.���H2S����ʱ���Ե缫����������Ե缫�ϵĵ缫��ӦʽΪO2+2H2O+4e���T4OH��
D.���H2S��CO���������ͬ�����ݿ�������ʱ���������ϲ����ĵ�����С��ͬ
���𰸡�B
���������⣺A��ʧ���ӷ���������Ӧ�ĵ缫�Ǹ������õ��ӷ�����ԭ��Ӧ�ĵ缫�����������ݴ�������ͷ�Ӧ�����֪������������Ԫ�ػ��ϼ�����������������Ԫ�صĻ��ϼ��½����������е缫��һ�����������������A����
B���������ʱ�������õ������������ӣ��缫��ӦʽΪCl2+2e���T2Cl�� �� ��B��ȷ��
C���������ʱ�������������ᣬ��Ԫ�ػ��ϼ��ɩ�2�۱�Ϊ+6�۶�����������Ӧ���������ڵ缫Ϊ�����������������õ��Ӻ������ӷ�Ӧ����ˮ���缫�缫��ӦʽΪO2+4H++4e���T2H2O����C����
D�������ĵ�����С��ʧ���Ӷ����йأ����H2S��CO���������ͬ�����ݿ�������ʱ������ʧȥ����������CO�����Բ���������С��ͬ����D����
��ѡB��
A��ʧ���ӷ���������Ӧ�ĵ缫�Ǹ������õ��ӷ�����ԭ��Ӧ�ĵ缫��������
B���������ʱ�������õ������������ӣ�
C���������ʱ�������������ᣬ��Ԫ�ط���������Ӧ���������ڵ缫Ϊ������
D�������ĵ�����С��ʧ���Ӷ����йأ�


 ���ݼ���ϵ�д�
���ݼ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС�������ʹ������װ��̽����ͭ��һ������Ũ���ᷴӦ�Ƿ���һ������������(�������������Ϊ��״����������������������Բ��ƣ�������Ũ����Ļӷ����Һ��Է�Ӧ�е���Һ����仯)

�Իش��������⣺
��1��ͭ�۵�������___________________����ͭ�۷�ɢ����ʯ�����е�ԭ��_____________��
��2����ͭ��Ũ���ᷴӦǰ���ر�k3����k1��k2 ,��ѹ������A��B��C��Ӧ����D�е�������_____(�ѧʽ)��
��3���ر�k1��k2����k3���ɷ�Һ©����D�еμ�Ũ���ᡣ��Cu��Ũ���ᷴӦ��������ͨ����Һ©����D�м���CCl4��������D��һ��������Ӧ�����ӷ���ʽΪ��____________��
��4��Eװ���з�����Ӧ�Ļ�ѧ����ʽΪ_____________________________��
��5����Eװ��������Һ��ȡ��25.00mL����0.1000 mol/L��NaOH��Һ�����кͣ���ǡ�ó�����ʱ����NaOH��Һ18.00mL����E��������������ʵ���Ũ��Ϊ_________mol/L����ʵ����Fװ�����ռ������������Ϊ139.00 mL��������ijɷ�Ϊ_________(�ѧʽ)����ͭ��һ������Ũ���ᷴӦ��______ mL NO���ɡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������÷�Һ©�������һ��Һ�������ǣ� ��
A.������Ȼ�̼
B.�����屽
C.���ͺͱ�
D.��������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ��Һ�к���H+��Al3+��Mg2+���������ӣ���μ���0.1moLL��1NaOH��Һ������NaOH��Һ�����X�ᣩ�����ɳ�����Y�ᣩ֮��ĺ�����ϵ��ͼ��ʾ������Һ��H+��Al3+��Mg2+���������ӵ����ʵ���Ũ��֮��Ϊ�� �� 
A.1��1��1
B.2��2��1
C.2��1��1
D.1��1��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������������ڻ��������ᴿ���ǣ� ��
A.©��
B.������ƿ
C.����ƿ
D.��Һ©��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ������������̽��SO2�����ʣ�ʵ��ʱ��Na2SO3�����ϵμ���Ũ���ᣬ��������һ����������档���ж�ʵ���������������Ͳ���ȷ����

ѡ�� | ʵ������ | ���� |
A | BaCl2��Һ����� | SO2��BaCl2��Һ��Ӧ������BaSO3���� |
B | Na2S��Һ����� | SO2��Na2S��Һ��Ӧ������S���� |
C | ����KMnO4��Һ��ɫ | SO2���л�ԭ�� |
D | Ʒ����Һ��ɫ | SO2����Ư���� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ��ƹ����ܽ���ˮʱ����Һ���¶ȱ仯����������Ϊ
A.ֻ����ˮ�Ϲ���
B.ֻ������ɢ����
C.ˮ�Ϲ��̷ų����������Ƶ�����ɢ�������յ�����
D.û����ЧӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ο���ͼ����Ҫ��ش��������⣺ 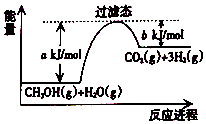
��1���״����ӽ���Ĥȼ�ϵ�ؽ��״�����ת��Ϊ������һ��ԭ����CH3OH��g����H2O��Ӧ����CO2��H2 �� ���ڷ�Ӧ��ϵ�м����������Ӧ������������Ӧ��� a�ı仯�������������С���������䡱������Ӧ�ȡ�H�ı仯�������������С���������䡱������д��CH3OH��g����H2O��g����Ӧ���Ȼ�ѧ����ʽ ��
��2���״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ��������һ�ַ�Ӧԭ���ǣ�
CH3OH��g��+ ![]() O2��g��CO2��g��+2H2��g����H=��c kJ/mol
O2��g��CO2��g��+2H2��g����H=��c kJ/mol
��֪H2O��g��H2O��l����H=��d kJ/mol��
��״�ȼ���ȵ��Ȼ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ1Ϊʵ������ȡ������ʵ��װ�á�

��1��д��A����������Ӧ�Ļ�ѧ����ʽ_______________________��Ҫ�ռ�����İ�����������____________________���������
��2�����ռ�����ʱ�Թܿ�����������___________��
��3��һλѧ�����Ƶõİ���,��ͼ2װ�ý�����Ȫʵ��,��ƿ�ѳ�������İ���,������Ȫʵ��IJ�����___________��
��4����һѧ������˼��������Ȫ����������,�����ͼ3װ�á���������ƿ�зֱ������������������,��Ӧ���ܲ�����Ȫ����___________��
A.CaCO3��ĩ��Ũ���� B.NH4HCO3��Һ��ϡNaOH��Һ
C.HCl��AgNO3��Һ D.HCl����ɫ��̪��Һ
��ͬѧ������ƿ�м���ƾ�,ˮ���м�����ˮ��,�ټ�����������������,���Ҳ��������Ȫ��ˮ���м�������ʿ�����___��
A.����� B.ʳ�� C.Ũ���� D.����ͭ
��5�����鰱���ѳ����Թ�B�ķ�����______________��
��6�����Ƶñ�״���µİ���2.24L����Ӧ��������Ҫ��ʯ��______g
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com