
【题目】向CuSO4溶液中加入H2O2溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊(Cu2O),继续加入H2O2溶液,红色浑浊又变为蓝色溶液,这个反应可以反复多次。下列关于上述过程的说法不正确的是
A. Cu2+是H2O2分解反应的催化剂 B. H2O2只表现了氧化性
C. H2O2的电子式为: ![]() D. 发生了反应Cu2O + H2O2+4H+=2Cu2++3H2O
D. 发生了反应Cu2O + H2O2+4H+=2Cu2++3H2O
【答案】B
【解析】A.向CuSO4溶液中加入H2O2溶液,很快有大量气体逸出,同时放热,说明Cu2+是H2O2分解反应的催化剂,故A正确;B.根据“蓝色溶液变为红色浑浊(Cu2O)”,说明铜离子被还原成+1价,H2O2表现了还原性;继续加入H2O2溶液,红色浑浊又变为蓝色溶液,说明发生了反应Cu2O+H2O2+4H+═2Cu2++3H2O,Cu2O中+1价Cu被氧化成+2价Cu2+,H2O2又表现了氧化性,故B错误;C.H2O2属于共价化合物,电子式为: ![]() ,故C正确;D.红色浑浊又变为蓝色溶液,Cu2O中+1价Cu被氧化成+2价Cu2+,发生反应为:Cu2O+H2O2+4H+═2Cu2++3H2O,故D正确;故选B。
,故C正确;D.红色浑浊又变为蓝色溶液,Cu2O中+1价Cu被氧化成+2价Cu2+,发生反应为:Cu2O+H2O2+4H+═2Cu2++3H2O,故D正确;故选B。


科目:高中化学 来源: 题型:
【题目】(题文)常温下,某水溶液M中存在的离子有Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式_________________________。
(2)若溶液M由10 mL 2 mol·L-1NaHA溶液与10 mL 2 mol·L-1 NaOH溶液等体积混合而成,则溶液M的pH________(填“<”“>”或“=”)7,溶液中离子浓度由大到小的顺序为______________。已知Ksp(BaA)=1.8×10-10,向该溶液中加入10 mL 1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为________mol·L-1。
(3)若有下列三种溶液:①0.01 mol·L-1的H2A溶液;②0.01 mol·L-1的NaHA溶液;③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合,则三种情况下,溶液中c(H2A)最大的是____________;pH由大到小的顺序为______________。
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液中![]() =104,V1与V2的大小关系为________(填“V1大于V2”“V1等于V2”“V1小于V2”或“均有可能”)。
=104,V1与V2的大小关系为________(填“V1大于V2”“V1等于V2”“V1小于V2”或“均有可能”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入 铜粉,最多能溶19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁 粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果不正确的是( )

A. 图中,AB段的反应为Fe+2Fe3+===3Fe2+,溶液中溶质最终为硫酸亚铁
B. 原溶液中硫酸浓度为2.5 mol·L-1
C. 原混合溶液中硝酸根离子的物质的量为0.4 mol
D. 图中,OA段产生的气体是一氧化氮,BC段产生的气体是氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:C(s)+O2(g)===CO2(g)ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(g)ΔH2=-483.6 kJ·mol-1
C(s)+H2O(g)===CO(g)+H2(g)ΔH3=131.3 kJ·mol-1
则反应CO(g)+H2(g)+O2(g)===H2O(g)+CO2(g)的ΔH=________kJ·mol-1。标准状况下的煤气(CO、H2)33.6 L与氧气反应生成CO2和H2O,反应过程中转移________mol电子。
(2)熔融碳酸盐燃料电池(MCFS),是用煤气(CO、H2)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物作电解质,以金属镍(燃料极)为催化剂制成的。负极的电极反应式为_________,则该电池的正极反应式是____________。
(3)密闭容器中充有10 mol CO与20 mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g);CO的转化率(α)与温度、压强的关系如图所示。
CH3OH(g);CO的转化率(α)与温度、压强的关系如图所示。
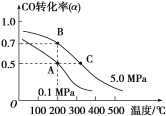
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10 L,则该温度下的平衡常数K=________;此时在B点时容器的体积VB________10 L(填“大于”“小于”或“等于”)。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA________tC(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以葡萄糖为原料制得的山梨醇(A)和异山梨醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物,由葡萄糖为原料合成E的过程如下:
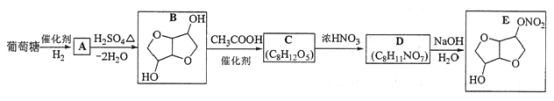
回答下列问题:
(1)葡萄糖的分子式为__________。
(2)A中含有的官能团的名称为__________。
(3)由B到C的反应类型为__________。
(4)C的结构简式为__________。
(5)由D到E的反应方程式为______________。
(6)F是B的同分异构体,7.30 g的F与足量饱和碳酸氢钠反应可释放出2.24 L二氧化碳(标准状况),F的可能结构共有________种(不考虑立体异构),其中核磁共振氢谱为三组峰,峰面积比为3∶1∶1的结构简式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过反应Ⅰ和Ⅱ来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100 L),在一定条件下发生反应:
CH4(g)+H2O(g)![]() CO(g)+3H2(g)……Ⅰ。CH4 的转化率与温度、压强的关系如图。
CO(g)+3H2(g)……Ⅰ。CH4 的转化率与温度、压强的关系如图。
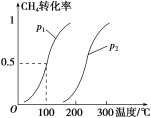
①已知100 ℃时达到平衡所需的时间为5 min,则用H2表示的平均反应速率为_______。
②图中的p1________p2(填“<”“>”或“=”)。
③该反应的ΔH________0(填“<”“>”或“=”)。
(2)在压强为0.1 MPa条件下,a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:
CO(g)+2H2(g)![]() CH3OH(g) ΔH<0……Ⅱ。
CH3OH(g) ΔH<0……Ⅱ。
①若容器容积不变,下列措施可增加甲醇产率的是________。
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1 mol CO和3 mol H2
②为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
1 | 150 | 1/3 | 0.1 |
2 | a | 1/3 | 5 |
3 | 350 | b | 5 |
A.则上表中剩余的实验条件数据:a=________,b=________。
B.根据反应Ⅱ的特点,如图是在压强分别为0.1 MPa和5 MPa下CO的转化率随温度变化的曲线图,请指明图中的压强px=________MPa。

(3)以甲醇作为燃料制成的燃料电池结构示意图如图所示。
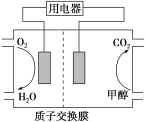
关于该电池的叙述正确的是________。
A.当电池反应消耗了1 mol甲醇时,溶液中转移了12NA个e-
B.电池的负极反应为CH3OH+H2O-6e-===CO2↑+6H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体22.4/3 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)常温下,某水溶液M中存在的离子有Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式_________________________。
(2)若溶液M由10 mL 2 mol·L-1NaHA溶液与10 mL 2 mol·L-1 NaOH溶液等体积混合而成,则溶液M的pH________(填“<”“>”或“=”)7,溶液中离子浓度由大到小的顺序为______________。已知Ksp(BaA)=1.8×10-10,向该溶液中加入10 mL 1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为________mol·L-1。
(3)若有下列三种溶液:①0.01 mol·L-1的H2A溶液;②0.01 mol·L-1的NaHA溶液;③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合,则三种情况下,溶液中c(H2A)最大的是____________;pH由大到小的顺序为______________。
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液中![]() =104,V1与V2的大小关系为________(填“V1大于V2”“V1等于V2”“V1小于V2”或“均有可能”)。
=104,V1与V2的大小关系为________(填“V1大于V2”“V1等于V2”“V1小于V2”或“均有可能”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置。A中反应方程式是________________(锰被还原为Mn2+)。
②C中得到紫色固体和溶液。C中Cl2发生的反应有(请配平)
_____Cl2+ Fe(OH)3+ KOH![]() K2FeO4+ KCl+ H2O
K2FeO4+ KCl+ H2O
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
i.由方案Ⅰ中溶液变红可知a中含有 Fe3+ 离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由________________产生(用方程式表示)。
ii.方案Ⅱ可证明K2FeO4氧化了Cl-
②根据K2FeO4的制备实验得出:氧化性Cl2________FeO42-(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用 H 2 还原 WO3 制备金属 W 的装置如下图所示(Zn 粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法错误的是

A. 反应开始时,先加热管式炉,再打开活塞 K
B. 往盐酸中加入少量 CuCl2,可加快产生 H2 的速率
C. ①、②、③中依次盛装 KMnO4 溶液、焦性没食子酸溶液、浓 H2SO4
D. 装置 Q(启普发生器)也可用于石灰石与盐酸反应制二氧化碳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com