
【题目】甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过反应Ⅰ和Ⅱ来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100 L),在一定条件下发生反应:
CH4(g)+H2O(g)![]() CO(g)+3H2(g)……Ⅰ。CH4 的转化率与温度、压强的关系如图。
CO(g)+3H2(g)……Ⅰ。CH4 的转化率与温度、压强的关系如图。
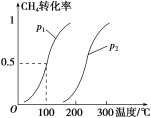
①已知100 ℃时达到平衡所需的时间为5 min,则用H2表示的平均反应速率为_______。
②图中的p1________p2(填“<”“>”或“=”)。
③该反应的ΔH________0(填“<”“>”或“=”)。
(2)在压强为0.1 MPa条件下,a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:
CO(g)+2H2(g)![]() CH3OH(g) ΔH<0……Ⅱ。
CH3OH(g) ΔH<0……Ⅱ。
①若容器容积不变,下列措施可增加甲醇产率的是________。
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1 mol CO和3 mol H2
②为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
1 | 150 | 1/3 | 0.1 |
2 | a | 1/3 | 5 |
3 | 350 | b | 5 |
A.则上表中剩余的实验条件数据:a=________,b=________。
B.根据反应Ⅱ的特点,如图是在压强分别为0.1 MPa和5 MPa下CO的转化率随温度变化的曲线图,请指明图中的压强px=________MPa。

(3)以甲醇作为燃料制成的燃料电池结构示意图如图所示。
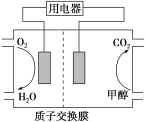
关于该电池的叙述正确的是________。
A.当电池反应消耗了1 mol甲醇时,溶液中转移了12NA个e-
B.电池的负极反应为CH3OH+H2O-6e-===CO2↑+6H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体22.4/3 L
【答案】0.003 0 mol/(L·min)<>BD1501/30.1B
【解析】
(1)①根据图知道平衡时甲烷的转化率,求出△c(CH4),根据v=△c/△t计算v(CH4),利用速率之比等于化学计量数之比计算v(H2)。
②相同温度下,对反应Ⅰ加压,平衡左移,CH4的转化率减小。
③相同压强下,升高温度,甲烷的转化率增大,平衡右移,该反应的正反应为吸热反应。
(2)①a项,由于反应物的总能量大于生成物的总能量,正反应为放热反应,升温,平衡逆向移动;b项,充入He(g),平衡不移动;c项,将H2O(g)从体系中分离出来,减小生成物浓度,平衡正向移动;d项,体积不变,再充入1mol CO2和3 mol H2,相当于增大压强的过程,平衡右移。
②研究合成甲醇的温度和压强的适宜条件,应该固定两种因素,研究一种因素的影响,对比实验1、2中的数据,即研究不同压强对反应的影响;对比实验2、3中的数据,即研究不同温度对反应的影响;根据图像可知,相同温度下,py时CO的转化率大于px时的转化率,再结合反应方程式的特点,找出压强pX和pY大小关系,可求出px数值。
(3)根据燃料电池的电池反应可知,甲醇在负极反应,电极反应式为CH3OH+H2O-6e-===CO2↑+6H+,正极反应式为O2+4e-+4H+===2H2O,根据极反应方程式可以计算出反应电子转移的数目及反应消耗氧气的体积(标况);原电池中电解质溶液中阳离子向正极移动,阴离子向负极移动。
(1)①根据图像,100 ℃达到平衡时CH4的转化率为50%,则平衡时生成H2的物质的量为1.5mol,v(H2)=![]() =0.0030mol/(L·min);正确答案:0.0030 mol/(L·min)。
=0.0030mol/(L·min);正确答案:0.0030 mol/(L·min)。
②相同温度下,对反应Ⅰ加压,平衡左移,CH4的转化率减小,故p1<p2;正确答案:<。
③相同压强下,升高温度,甲烷的转化率增大,平衡右移,该反应的正反应为吸热反应,ΔH>0;正确答案:>。
(2)①反应Ⅱ为气体体积减小的放热反应,降温或加压都可以增加甲醇的产率,但是在容器容积不变的条件下,充入He,使体系总压强增大,由于未影响反应体系中各物质的浓度,平衡不移动,A、C不能增加甲醇的产率;将CH3OH(g)从体系中分离,平衡右移;容器容积不变的条件下,再充入1molCO和3molH2相当于加压,平衡右移,故B、D两选项的措施可以增加甲醇的产率;正确选项BD。
②研究合成甲醇的温度和压强的适宜条件,应该固定两种因素,研究一种因素的影响,对比实验1、2中的数据可知,a=150,即研究不同压强对反应的影响;对比实验2、3中的数据可知,b=1/3,即研究不同温度对反应的影响。相同温度下,py时CO的转化率大于px时的转化率,再结合反应方程式的特点,可知px<py,则px=0.1MPa;正确答案:150;1/3; 0.1。
(3)根据燃料电池的电池反应可知,甲醇在负极反应,电极反应式为CH3OH+H2O-6e-===CO2↑+6H+,正极反应式为O2+4e-+4H+===2H2O,B项正确;当电池反应消耗了2 mol甲醇时,电路中转移了12NA个e-,A项错误;放电过程中,H+从负极区向正极区迁移,C项错误;由电子守恒,每消耗1mol氧气,理论上能生成标准状况下CO2气体44.8/3L,D项错误;正确选项B。


科目:高中化学 来源: 题型:
【题目】关于下图所示转化关系(X代表卤素),说法不正确的是

A.2H(g) +2X(g) == 2HX(g) ΔH3<0
B.途径Ⅰ生成HX的反应热与途径无关,所以ΔH1 = ΔH2 + ΔH3
C.Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多
D.途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如下图

下列关于该高分子的说法正确的是
A. 完全水解产物的单个分子中,苯环上的氢原子具有不同的化学环境
B. 完全水解产物的单个分子中,含有官能团―COOH或―NH2
C. 氢键对该高分子的性能没有影响
D. 结构简式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向CuSO4溶液中加入H2O2溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊(Cu2O),继续加入H2O2溶液,红色浑浊又变为蓝色溶液,这个反应可以反复多次。下列关于上述过程的说法不正确的是
A. Cu2+是H2O2分解反应的催化剂 B. H2O2只表现了氧化性
C. H2O2的电子式为: ![]() D. 发生了反应Cu2O + H2O2+4H+=2Cu2++3H2O
D. 发生了反应Cu2O + H2O2+4H+=2Cu2++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:2A(g)+3B(g)![]() C(g)+4D(g),速率最快的是( )
C(g)+4D(g),速率最快的是( )
A. v(C)=0.1mol·L-1·s-1 B. v(B)=4.0 mol·L-1·min-1
C. v(A)=2.0mol·L-1·min-1 D. v(D)=0.3mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为一常见的坐标曲线图。该图能够表示的生物学含义是

A. 人红细胞中K+吸收量随O2浓度变化的情况
B. 细胞代谢中反应速率随底物浓度变化的情况
C. 某植物光合作用速率随光照强度变化的情况
D. 萌发的种子中自由水含量随时间变化的情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示。下列说法正确的是

A. 石墨电极上发生氧化反应
B. 根据图示,物质A为CO2
C. 为增强污水的导电能力,可向污水中加入适量乙醇
D. 甲烷燃料电池中CO32-向空气一极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com