
【题目】CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:C(s)+O2(g)===CO2(g)ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(g)ΔH2=-483.6 kJ·mol-1
C(s)+H2O(g)===CO(g)+H2(g)ΔH3=131.3 kJ·mol-1
则反应CO(g)+H2(g)+O2(g)===H2O(g)+CO2(g)的ΔH=________kJ·mol-1。标准状况下的煤气(CO、H2)33.6 L与氧气反应生成CO2和H2O,反应过程中转移________mol电子。
(2)熔融碳酸盐燃料电池(MCFS),是用煤气(CO、H2)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物作电解质,以金属镍(燃料极)为催化剂制成的。负极的电极反应式为_________,则该电池的正极反应式是____________。
(3)密闭容器中充有10 mol CO与20 mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g);CO的转化率(α)与温度、压强的关系如图所示。
CH3OH(g);CO的转化率(α)与温度、压强的关系如图所示。
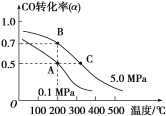
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10 L,则该温度下的平衡常数K=________;此时在B点时容器的体积VB________10 L(填“大于”“小于”或“等于”)。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA________tC(填“大于”“小于”或“等于”)。
【答案】-524.83CO-2e-+CO![]() ===2CO2 H2-2e-+CO
===2CO2 H2-2e-+CO![]() ===CO2+H2O O2+4e-+2CO2===2CO
===CO2+H2O O2+4e-+2CO2===2CO![]() 1小于大于
1小于大于
【解析】
(1)将给定的热化学方程式的第一个反应式减去第三个反应式即能得到所求的热化学方程式及反应热;无论是1molCO还是1molH2,在燃烧过程中都失去2mol电子,故1.5 mol煤气反应过程中共转移3 mol电子。
(2)CO在负极上失去电子后结合迁移过来的CO![]() 而形成CO2,H2在负极上失去电子后结合迁移过来的CO
而形成CO2,H2在负极上失去电子后结合迁移过来的CO![]() 后生成CO2和H2O;在正极上是O2得电子后结合空气中的CO2后生成CO
后生成CO2和H2O;在正极上是O2得电子后结合空气中的CO2后生成CO![]() ,按此规律书写极反应方程式。
,按此规律书写极反应方程式。
(3)①由A点时根据CO的转化率可以求出平衡时三种气体的浓度,代入公式K=![]() 可得平衡常数;因B点的压强大于A点的压强,故B点容器的体积小于10 L。
可得平衡常数;因B点的压强大于A点的压强,故B点容器的体积小于10 L。
②C点的压强大、温度高,反应速率快,达平衡用的时间短。
(1)根据①C(s)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1;②2H2(g)+O2(g)=2H2O(g) △H2=-483.6kJ·mol-1;③C(s)+H2O(g)=CO(g)+H2(g) △H3=+131.3kJ·mol-1三个热化学方程式,利用盖斯定律,将①-③可得反应:CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g),△H=-393.5kJmol-1-131.3kJmol-1=-524.8kJmol-1;CO、H2与氧气反应的方程式分别为:2CO+O2![]() 2CO2;2H2+O2
2CO2;2H2+O2![]() 2H2O,从方程式可以看出相同物质的量的CO、H2燃烧转移的电子数目相等,且1molCO或1molH2转移的电子为2mol,所以标准状况下CO、H233.6L与氧气反应生成CO2和H2O,转移的电子的物质的量为:(33.6×2)/22.4×2=3mol;正确答案:-524.8;3。
2H2O,从方程式可以看出相同物质的量的CO、H2燃烧转移的电子数目相等,且1molCO或1molH2转移的电子为2mol,所以标准状况下CO、H233.6L与氧气反应生成CO2和H2O,转移的电子的物质的量为:(33.6×2)/22.4×2=3mol;正确答案:-524.8;3。
(2)CO在负极失去电子后结合电解质溶液中的CO32-生成CO2,H2在负极失去电子后结合电解质溶液中的CO32-生成CO2和H2O,则负极的电极反应式为:CO-2e-+CO32-=2CO2、H2-2e-+CO32-=CO2+H2O;O2在正极得电子后结合CO2生成CO32-,则该电池的正极反应式为:O2+4e-+2CO2=2CO32-;正确答案:CO-2e-+CO![]() ===2CO2 ,H2-2e-+CO
===2CO2 ,H2-2e-+CO![]() ===CO2+H2O;O2+4e-+2CO2===2CO
===CO2+H2O;O2+4e-+2CO2===2CO![]() 。
。
(3)①根据图象可以看出,A点时CO的转化率为50%,在A点时容器的体积为10L,则平衡时各物质的量浓度为:c(CO)=0.5mol/L、c(H2)=1mol/L、c(CH3OH)=0.5mol/L;所以平衡常数K=c(CH3OH)/c(CO)×c2(H2)=0.5/(0.5×12)=1;B点CO转化率比A点CO转化率大,则B点压强比A点大,故B点容器的体积小于10L;正确答案: 1; 小于。
②升高温度,反应速率增大,反应开始到达平衡状态所需的时间要少,C点比A点温度高,所以反应开始到达平衡状态所需的时间tA大于tC;正确答案:大于。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】探究物质的结构有助于对物质的性质进行研究。
(1)① 下列物质中含有羧基的是____(填字母)。
a.![]() b.
b.![]() c.
c.
② 下列物质分子中所有原子处于同一平面的是____(填字母)。
a.苯 b.丙烯 c.甲醇
③ 欲区分乙醛和乙酸,应选用____(填字母)。
a.NaOH溶液 b.HCl溶液 c.NaHCO3溶液
(2) 书写方程式并写出反应①和②的反应类型:
①甲烷与氯气在光照条件下的反应(写第一步)__________________;
②乙烯使溴水或溴的四氯化碳溶液褪色__________________;
③乙醇与金属钠的反应________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系的表述中,正确的是
A. 0.1 mol·L-1NaHSO4溶液中:c(Na+)+c(H+)=c(SO![]() )+c(OH-)
)+c(OH-)
B. 中和pH和体积都相同的硝酸和醋酸溶液,消耗NaOH的物质的量之比为1∶1
C. 0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(HCO![]() )>c(CO
)>c(CO![]() )>c(H2CO3)
)>c(H2CO3)
D. pH=3的盐酸和pH=3的AlCl3溶液中,水电离出的c(H+)后者大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如下图

下列关于该高分子的说法正确的是
A. 完全水解产物的单个分子中,苯环上的氢原子具有不同的化学环境
B. 完全水解产物的单个分子中,含有官能团―COOH或―NH2
C. 氢键对该高分子的性能没有影响
D. 结构简式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
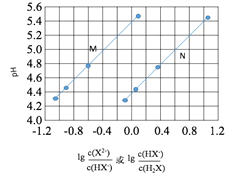
A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向CuSO4溶液中加入H2O2溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊(Cu2O),继续加入H2O2溶液,红色浑浊又变为蓝色溶液,这个反应可以反复多次。下列关于上述过程的说法不正确的是
A. Cu2+是H2O2分解反应的催化剂 B. H2O2只表现了氧化性
C. H2O2的电子式为: ![]() D. 发生了反应Cu2O + H2O2+4H+=2Cu2++3H2O
D. 发生了反应Cu2O + H2O2+4H+=2Cu2++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:2A(g)+3B(g)![]() C(g)+4D(g),速率最快的是( )
C(g)+4D(g),速率最快的是( )
A. v(C)=0.1mol·L-1·s-1 B. v(B)=4.0 mol·L-1·min-1
C. v(A)=2.0mol·L-1·min-1 D. v(D)=0.3mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯气的说法不正确的是( )
A. 氯气和液氯是两种不同的物质
B. 可以用浓硫酸除去氯气中的水蒸气
C. 氯气是一种有毒气体,但可用于自来水的杀菌消毒
D. 尽管氯气的化学性质很活泼,但是纯净的液氯能用钢瓶贮存
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com