
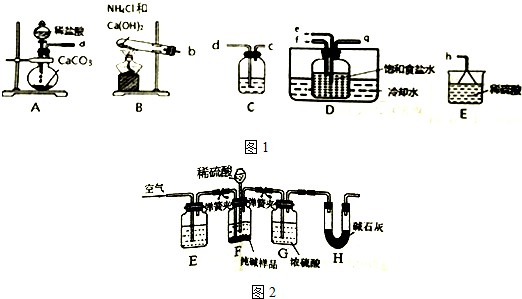
分析 (1)碳酸氢钠分解生成碳酸钠、水、二氧化碳;
(2)①氨气极易溶于水,需要防止倒吸,所以通入氨气的导管应该稍稍接触液面,即b连接f;
②装置B为氯化铵与氢氧化钙混合加热生成氯化氨气和水;
③根据实验原理NaCl+CO2+NH3+H2O═NaHCO3↓+NH4Cl,则为了增大碳酸氢钠的产量即要增大二氧化碳的溶解,据此分析;
④根据制备二氧化碳时会含有氯化氢杂质气体,所以装置C为除去二氧化碳中的HCl;
(3)①检验装置F气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,利用压强变化和液面变化分析判断;
②实验装置中会残留部分二氧化碳,影响H中二氧化碳质量的测定,需要通入空气将装置内的二氧化碳完全排入H中被吸收,空气中含有二氧化碳,故应先用氢氧化钠溶液吸收,防止影响二氧化碳的测定;浓硫酸具有吸水性,能够吸收二氧化碳中的水分;
③测定Na2CO3的含量则根据$\frac{碳酸钠质量}{样品总质量}$×100%计算,据此分析;
④H后缺少吸收空气中二氧化碳和水的装置,则空气中的二氧化碳和水蒸气被装置H吸收,称量质量增大,Na2CO3的含量将偏高.
解答 解:(1)碳酸氢钠分解生成碳酸钠、水、二氧化碳,反应为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(2)①操作过程,向氨化后饱和食盐水中通入二氧化碳、氨气发生反应生成碳酸氢钠,氨气极易溶于水,应该将D中通氨气导管末端刚刚接触液面,所以a接e、b接f,故答案为:e;f;
②装置B为氯化铵与氢氧化钙混合加热生成氯化氨气和水,反应的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
③根据实验原理NaCl+CO2+NH3+H2O═NaHCO3↓+NH4Cl,则为了增大碳酸氢钠的产量即要增大二氧化的溶液,所以先实验中要求先通入NH3,过量之后溶液成碱性再通入CO2,故答案为:NH3;CO2;
④根据制备二氧化碳时会含有氯化氢杂质气体,所以装置C装饱和NaHCO3,除去二氧化碳中的HCl,故答案为:饱和NaHCO3;除去二氧化碳中的HCl;
故答案为:用蘸有浓盐酸的玻璃棒靠近管口f,若有白烟生成,说明氨气过量(或用湿润的红色石蕊试纸靠进管口f,若试纸变蓝,说明氨气过量);
(3)①检验装置F气密性的方法为:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若漏斗中与试剂瓶中的液面差保持不再变化,证明装置气密性完好,
故答案为:液面不下降;
②实验装置中会残留部分二氧化碳,影响H中二氧化碳质量的测定,需要通入空气将装置内的二氧化碳完全排入H中被吸收,空气中含有二氧化碳,故应先用氢氧化钠溶液吸收,防止影响二氧化碳的测定;从装置F产生的二氧化碳气体中会有水,影响测定结果,需要用装置G干燥二氧化碳,减小测定误差,故答案为:NaOH溶液;干燥CO2;
③测定Na2CO3的含量则根据$\frac{碳酸钠质量}{样品总质量}$×100%计算,碳酸钠质量则根据H碱石灰的增重即二氧化碳质量计算可得,样品总质量可以开始称量,所以实验中需要测定的数据有固体样品质量和H碱石灰的增重,故答案为:固体样品质量和H碱石灰的增重;
④装置H直接与空气相连,则空气中的二氧化碳和水蒸气被装置H吸收,导致H装置的称量质量增大,测定的Na2CO3的含量将偏高,所以该装置的缺陷是装置H后缺少盛有碱石灰的干燥装置,
故答案为:在装置H后增加一个盛有碱石灰的干燥装置.
点评 本题考查了纯碱工业的生成原理及其应用,题目难度中等,明确实验目的及化学实验基本操作方法为解答关键,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验能力.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{576V}$ mol•L-1 | B. | $\frac{a}{125}$ mol•L-1 | C. | $\frac{250a}{36V}$mol•L-1 | D. | $\frac{250a}{48V}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 雾是气溶胶,在阳光下可观察到丁达尔效应 | |
| B. | 预制备Fe(OH)3胶体,向盛有沸水的烧杯中加入FeCl3饱和溶液煮沸得红褐色沉淀 | |
| C. | 用石膏或卤水点制豆腐利用了胶体的性质 | |
| D. | 用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Cu2+、Cl-、SO42- | B. | Fe3+、K+、SO42-、NO3- | ||
| C. | H+、Mg2+、OH-、NO3- | D. | Na+、Ca2+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
温度/K | 298 | 398 | 498 | … |
| 平衡常数(K) | 4.1×105 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
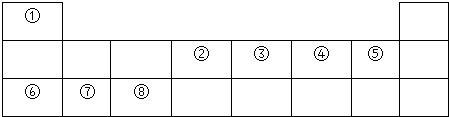
. .
. ,其晶体类型属于分子晶体,④与⑥形成的原子个数比为1:1的化合物的电子式是
,其晶体类型属于分子晶体,④与⑥形成的原子个数比为1:1的化合物的电子式是 ,其晶体类型属于离子晶体.
,其晶体类型属于离子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
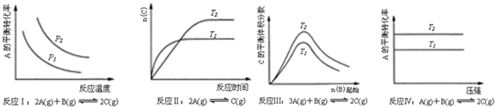
| A. | 反应Ⅰ:△H>0,P2>P1 | B. | 反应Ⅱ:△H<0,T1>T2 | ||
| C. | 反应Ⅲ:△H<0,T2>T1 | D. | 反应Ⅳ:△H<0,T2>T1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com