
【题目】下列指定反应的离子方程式正确的是( )
A. 饱和Na2CO3溶液与BaSO4固体反应:CO32-+Ba2+![]() BaCO3
BaCO3
B. NH4HCO3溶液和过量Ca(OH)2溶液混合:Ca2++NH4++HCO3-+2OH-===CaCO3↓+H2O+ NH3·H2O
C. NaClO与HI溶液反应:2ClO-+2H2O+2I-===I2+Cl2↑+4OH-
D. 电解氯化镁溶液:2Cl-+Mg2+![]() Cl2↑+Mg
Cl2↑+Mg
【答案】B
【解析】
按照离子方程式的书写步骤:写、拆、删、查,分析判断正误。
A项:BaSO4难溶于水,不能拆写。饱和Na2CO3溶液使BaSO4转化的离子方程式为:CO32-+BaSO4![]() BaCO3+SO42- ,A项错误;
BaCO3+SO42- ,A项错误;
B项:Ca(OH)2溶液过量,NH4+、HCO3-完全反应,B项正确;
C项:NaClO作氧化剂,被还原成Cl-而不是Cl2,酸性溶液中也不会生成OH-,离子方程式应写ClO-+2I-+2H+=I2+Cl-+H2O,C项错误;
D项:电解氯化镁溶液时,阴极氢离子得电子生成氢气,离子方程式应为:Mg2++2Cl-+2H2O![]() Cl2↑+H2↑+Mg(OH)2↓。
Cl2↑+H2↑+Mg(OH)2↓。
本题选B。


科目:高中化学 来源: 题型:
【题目】有机物a和苯通过反应合成b的过程可表示为下图(无机小分子产物略去)。下列说法正确的是
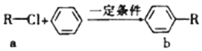
A. 该反应是加成反应
B. 若R为CH3时,b中所有原子可能共面
C. 若R为C4H9时,取代b苯环上的氢的一氯代物的可能的结构共有12种
D. 若R为C2H5时,1mol b最多可以与4molH2加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算。
(1)含0.3 mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是___________。
(2)___________g H2O2所含原子数与0.2molH3PO4所含原子数相等。
(3)质量相同的H2、NH3、SO2、O3四种气体中,含有分子数目最少的是____________。
(4)如果规定,1mol粒子集合体所含的粒子数与0.024kg 12C中所含的碳原子数相同。那么将36.5gHCl溶于水中配成溶液500mL,则溶液的浓度为_____________mol/L。
(5)同温同压下,某容器充满氧气重116g,若充满二氧化碳重122g,现充满某气体重114g,则该气体的摩尔质量为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 实验室用大理石与乙酸反应制取二氧化碳:CaCO3+2H+=Ca2++CO2↑+H2O
B. 氯乙酸与氢氧化钠溶液共热: CH2ClCOOH+OH-→CH2ClCOO-+H2O
C. 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
D. 酸性高锰酸钾与草酸反应:2MnO4-+5H2C2O4+6H+ =2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)为无色透明的油状发烟液体,是一种重要的精细化工原料,其制备的反应原理为NaClO+2NH3===N2H4·H2O+NaCl。下列关于实验室制备水合肼的操作不正确的是( )
甲 乙
乙 丙
丙 丁
丁
A. 装置甲中试剂X可以选择生石灰 B. 装置乙作为反应过程的安全瓶
C. 装置丙制备水合肼时氨气从b口进入 D. 装置丁可用于吸收多余的尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. NaCl(aq) ![]() Cl2
Cl2![]() 漂白粉
漂白粉
B. (C6H10O5)n(淀粉) ![]() C6H12O6(葡萄糖)
C6H12O6(葡萄糖) ![]() C2H5OH
C2H5OH
C. NH3·H2O![]() (NH4)2SO3
(NH4)2SO3![]() (NH4)2SO4
(NH4)2SO4
D. Fe2O3(s) 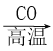 Fe(s)
Fe(s) ![]() FeCl3(aq)
FeCl3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
A. 对该反应体系加热
B. 不用稀硫酸,改用98%的浓硫酸
C. 滴加少量CuSO4溶液
D. 不用铁片,改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)工业上过氧化氢是重要的氧化剂和还原剂。常用于消毒、杀菌、漂白等。某化学兴趣小组的同学围绕过氧化氢开展了调查研究与实验,请你参与其中一起完成下列学习任务:
(1)该兴趣小组的同学查阅资料后发现H2O2为二元弱酸,其酸性比碳酸弱。请写出H2O2在水溶液中的电离方程式:____________________________。
(2)同学们用0.1000mol/L-1的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量,反应原理为2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑。
①在该反应中,H2O2被_________(填“氧化”或“还原”)。
②滴定到达终点的现象是____________________________。
③用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的酸性KMnO4标准溶液体积如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 17.10 | 18.10 | 17.00 | 16.90 |
则试样中过氧化氢的浓度为__________mol/L-1。
(II)医学上常用酸性高锰酸钾溶液和草酸溶液的反应来测定血钙的含量。测定含量如下:取2mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀疏酸溶解得到H2C2O4后,再用KMnO4溶液滴定。
(1)滴定时,用_____(填酸或碱)式滴定管装KMnO4溶液。
(2)下列操作会引起测定结果偏高的是______。
A.滴定管在盛装高锰酸钾前未润洗
B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C.滴定前读数正确,滴定终点时俯视读数
D.锥形瓶未用待测液润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2O4(g)![]() 2NO2(g) △H>0,平衡体系中气体的平均摩尔质量(
2NO2(g) △H>0,平衡体系中气体的平均摩尔质量(![]() )在不同温度下随压强的变化曲线如图所示。下列说法正确的是
)在不同温度下随压强的变化曲线如图所示。下列说法正确的是

A. 温度:T1<T2 B. 平衡常数:K(a)=K(b)<K(c)
C. 反应速率:v(b)>v(a) D. 当![]() =69g/mol时,n(NO2):n(N2O4)=2:1
=69g/mol时,n(NO2):n(N2O4)=2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com