
【题目】下列离子方程式正确的是( )
A. 实验室用大理石与乙酸反应制取二氧化碳:CaCO3+2H+=Ca2++CO2↑+H2O
B. 氯乙酸与氢氧化钠溶液共热: CH2ClCOOH+OH-→CH2ClCOO-+H2O
C. 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
D. 酸性高锰酸钾与草酸反应:2MnO4-+5H2C2O4+6H+ =2Mn2++10CO2↑+8H2O
【答案】D
【解析】
A.醋酸不能拆开,需要保留分子式,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,A项错误;
B.向CH2ClCOOH中加入足量的氢氧化钠溶液并加热,-Cl会水解生成-OH,-COOH会发生中和反应,正确的离子反应为:![]() ,B项错误;
,B项错误;
C.溶液中通入少量CO2,由于苯酚的酸性大于碳酸氢根离子,二者反应生成苯酚和碳酸氢根离子,正确的离子方程式为:CO2+H2O+C6H5O-→C6H5OH+HCO3-,C项错误;
D.酸性高锰酸钾溶液与草酸反应的离子反应为:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】有机物M是一种食品香料可以C4H10为原料通过如图所示路线合成:
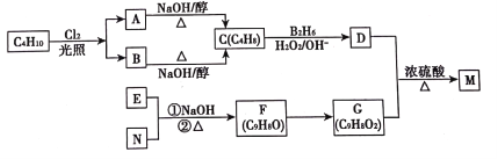
已知:①R—CH==CH2 ![]() R—CH2CH2OH
R—CH2CH2OH
②RCH2CHO+R′CH2CHO ![]()

③C、F分子中的碳链上C有支链,F没有支链;E为芳香族化合物且E、N都能发生银镜反应。请回答下列问题:
(1)A、B均为一氯代烃,写出其中一种的名称(系统命名)___________;M中的含氧官能团名称为___________。
(2)写出下列反应的反应类型:D+G→M___________。
(3)F与新制Cu(OH)2/NaOH(aq)反应的化学方程式为_______________________________。
(4)M的结构简式为___________________。
(5)与G具有相同官能团的G的芳香类同分异构体有___________种。
(6)参照上述合成路线,以苯乙烯( )和乙醛为原料(无机试剂任选),设计制备
)和乙醛为原料(无机试剂任选),设计制备![]() —C H2CH== CHCHO的合成路线:____________________________________________。
—C H2CH== CHCHO的合成路线:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为某二次电池充电时的工作原理示意图,该过程可实现盐溶液的淡化。下列说法错误的是

A. 充电时,a 为电源正极
B. 充电时,Cl-向Bi 电极移动,Na+向NaTi2(PO4)3 电极移动
C. 放电时,正极的电极反应为BiOCl+2H++3e-=Bi+Cl-+H2O
D. 充电时,新增入电极中的物质:n(Na+):n(Cl-) =1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用平衡移动原理解释的是
A. 夏天打开啤酒瓶盖后产生大量气泡
B. 浓氨水中加入NaOH 固体产生有刺激性气味气体
C. 实验室用排饱和食盐水的方法收集氯气
D. 压缩H2和I2反应的平衡混合气体,气体颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子中各种化学键如下图所示,

下列关于反应的断键位置的说明错误的是( )
A. 乙醇和乙酸、浓H2SO4共热时断键②
B. 乙醇和金属钠的反应断键①
C. 乙醇和浓H2SO4共热到170℃时断键②⑤
D. 乙醇在Ag催化下与O2反应时断键①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 饱和Na2CO3溶液与BaSO4固体反应:CO32-+Ba2+![]() BaCO3
BaCO3
B. NH4HCO3溶液和过量Ca(OH)2溶液混合:Ca2++NH4++HCO3-+2OH-===CaCO3↓+H2O+ NH3·H2O
C. NaClO与HI溶液反应:2ClO-+2H2O+2I-===I2+Cl2↑+4OH-
D. 电解氯化镁溶液:2Cl-+Mg2+![]() Cl2↑+Mg
Cl2↑+Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.反应在前50 s的平均速率为v(PCl3)=0.0032mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0mol PCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含砷(As)的有毒工业废水经下图流醒转化为粗As2O3,已知:亚砷酸钙微溶于水,砷酸钙难溶于水。

(1)砷是氮的同族元素,且比氮多2个电子层,则AsH3的电子式为_____。
(2)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应的离子方程式为_____。
(3)加入试剂1的目的是_____。
(4)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
A.Ca(OH)2(s)Ca2+(aq)+2OH﹣(aq)△H<0
B.5Ca2++OH﹣+3AsO43﹣Ca5(AsO4)3OH△H>0
资料表明:“沉砷”的最佳温度是85℃,温度高于85℃,随温度升高沉淀率下降,从平衡移动角度分析其原因是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com