
【题目】乙醇分子中各种化学键如下图所示,

下列关于反应的断键位置的说明错误的是( )
A. 乙醇和乙酸、浓H2SO4共热时断键②
B. 乙醇和金属钠的反应断键①
C. 乙醇和浓H2SO4共热到170℃时断键②⑤
D. 乙醇在Ag催化下与O2反应时断键①③
科目:高中化学 来源: 题型:
【题目】三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是
A. 原子数目相等的三种气体,质量最大的是Z
B. 同温同压下,同质量的三种气体,气体密度最小的是X
C. 若一定条件下,三种气体体积均为2.24 L,则它们的物质的量一定均为0.1 mol
D. 同温下,体积相同的两容器分别充2 g Y气体和1 g Z气体,则其压强比为2︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制240 mL 1.0 mol/L的稀硫酸。可供选用的仪器有:①玻璃棒;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平;⑦胶头滴管。请回答下列问题:

(1)配制上述稀硫酸时,还缺少的仪器有______________(写仪器名称);
(2)标签所示浓硫酸的物质的量浓度为__________________
(3)配制240 mL 1.0 mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为______,量取硫酸时应选用以下_____规格的量筒(填选项)。
A.10 mL B.25 mL C.50 mL D.100 mL
(4)根据计算结果,进行如下实验操作:①用量筒量取计算所需体积的浓硫酸;②向量筒中加入少量蒸馏水,并用玻璃棒搅拌;③立即将稀释后的溶液转入容量瓶中;④然后将蒸馏水沿玻璃棒注入容量瓶直至刻度线;⑤把容量瓶盖盖紧,上下颠倒摇匀。
你认为上述实验中错误的操作是______________________________(填序号)
(5)经过测定,某同学配制的稀硫酸浓度偏高,则可能的原因是_______(填序号)
①用量筒量取浓硫酸时,仰视刻度线②容量瓶用蒸馏水洗涤后未经干燥③洗涤烧杯内壁后将洗涤液弃去④转移溶液时,不慎有少量溶液洒出⑤定容时,俯视容量瓶刻度线⑥定容、摇匀后发现溶液的凹液面低于刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:①稀硫酸 ②小苏打 ③氨水 ④二氧化碳 ⑤FeCl3固体 ⑥稀NaOH溶液 ⑦硝酸亚铁溶液。
(1)上述物质中属于电解质的物质序号为______ 。
(2)有两种物质发生反应的离子方程式为:H++OH-=H2O,这两种物质的序号是______。
(3)加入盐酸、NaOH溶液均能发生化学反应的物质序号为______。
(4)能导电的物质序号为_______________。
(5)④与⑥充分反应后,将溶液小火蒸干,得到固体混合物。固体组成成分可能是(用化学式表示)___________________________。
(6)实验室用⑤制备胶体的化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 实验室用大理石与乙酸反应制取二氧化碳:CaCO3+2H+=Ca2++CO2↑+H2O
B. 氯乙酸与氢氧化钠溶液共热: CH2ClCOOH+OH-→CH2ClCOO-+H2O
C. 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
D. 酸性高锰酸钾与草酸反应:2MnO4-+5H2C2O4+6H+ =2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可降解聚合物P的合成路线如下

(1)A的含氧官能团名称是____________。
(2)羧酸a的电离方程是________________。
(3)B→C的化学方程式是_____________。
(4)化合物D苯环上的一氯代物有2种,D的结构简式是___________。
(5)E→F中反应①和②的反应类型分别是___________。
(6)F的结构简式是_____________。
(7)聚合物P的结构简式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. NaCl(aq) ![]() Cl2
Cl2![]() 漂白粉
漂白粉
B. (C6H10O5)n(淀粉) ![]() C6H12O6(葡萄糖)
C6H12O6(葡萄糖) ![]() C2H5OH
C2H5OH
C. NH3·H2O![]() (NH4)2SO3
(NH4)2SO3![]() (NH4)2SO4
(NH4)2SO4
D. Fe2O3(s) 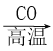 Fe(s)
Fe(s) ![]() FeCl3(aq)
FeCl3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向25mL0.1mol/LMOH 溶液中逐滴加入0.2mol/LHA 溶液,曲线如图所示(体积变化忽略不计)。回答下列问题

(1)写出MOH 的电离方程式_______;
(2)HA为_______(“强”或“弱”)酸,理由是_______;HA的电离平衡常数为_______;
(3)D点时,溶液中c(A)+c(HA) _______2c(M+) (填“>”“<”或“=”); 溶液中离子浓度大小关系为_______;若此时测得混合溶液的pH=3,则c(HA)+c(H+)=_______mol/L。(准确值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应的实验,能达到实验目的是

A. 实验室用甲装置制取氯气
B. 盛有水的乙装置,吸收NH3气体
C. 用丙装置对生成的气体体积进行测量可以减少误差
D. 用丁装置灼烧FeSO47H2O晶体得到固体FeSO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com