
【题目】常温下,向25mL0.1mol/LMOH 溶液中逐滴加入0.2mol/LHA 溶液,曲线如图所示(体积变化忽略不计)。回答下列问题

(1)写出MOH 的电离方程式_______;
(2)HA为_______(“强”或“弱”)酸,理由是_______;HA的电离平衡常数为_______;
(3)D点时,溶液中c(A)+c(HA) _______2c(M+) (填“>”“<”或“=”); 溶液中离子浓度大小关系为_______;若此时测得混合溶液的pH=3,则c(HA)+c(H+)=_______mol/L。(准确值)
【答案】MOH=M++OH- 弱 当加入13mLHA 溶液时,酸稍过量,而此时pH=7,说明MA 呈碱性,即为强碱弱酸盐,说明HA为弱酸 2.5×10-6 = c(A-)>c(M+)>c (H+)>c(OH-) 0.05+10-11
【解析】
(1)由图象可知0.1mol/L MOH溶液的pH=13,c(OH-)=0.1mol/L,说明为MOH强碱,完全电离,电离方程式为MOH=M++OH-;(2)HA为弱酸,理由是当加入13mIHA 溶液时,酸稍过量,而此时pH=7,说明MA呈碱性,即为强碱弱酸盐,说明HA为弱酸; n(HA)=0.0026mol,而n(MOH)=0.0025mol,说明HA过量,但溶液呈中性,说明HA为弱酸,如二者恰好反应,应生成强碱弱酸盐,水解呈碱性,发生A-+H2OHA+OH-,当加入13mL 时水解平衡常数K=![]() =
= =
=![]() ,所以Ka=
,所以Ka=![]() =
=![]() =2.5×10-13;(3)D点时,加入n(HA)=0.005mol,而加入n(MOH)=0.0025mol,A元素以A-和HA两种形式存在,而M全以M+形式存在,溶液中c(A-)+c(HA)=2c(M+),溶液以HA和MA按1:1形成的溶液,溶液呈酸性,则溶液中离子浓度大小关系为c(A-)>c(M+)>c (H+)>c(OH-);c(M+)=0.05mol/L,c(OH-)=1×10-11mol/L,由电荷守恒c(M+)+c(H+)=c(A-)+c(OH-)和物料守恒c(A-)+c(HA)=2c(M+),求得c(HA)+c(H+)=c(M+)+c(OH-)=0.05mol/L+10-11mol/L。
=2.5×10-13;(3)D点时,加入n(HA)=0.005mol,而加入n(MOH)=0.0025mol,A元素以A-和HA两种形式存在,而M全以M+形式存在,溶液中c(A-)+c(HA)=2c(M+),溶液以HA和MA按1:1形成的溶液,溶液呈酸性,则溶液中离子浓度大小关系为c(A-)>c(M+)>c (H+)>c(OH-);c(M+)=0.05mol/L,c(OH-)=1×10-11mol/L,由电荷守恒c(M+)+c(H+)=c(A-)+c(OH-)和物料守恒c(A-)+c(HA)=2c(M+),求得c(HA)+c(H+)=c(M+)+c(OH-)=0.05mol/L+10-11mol/L。


科目:高中化学 来源: 题型:
【题目】四氯化锡可用作媒染剂。利用如图所示装置可以制备四氯化锡(部分夹持装置已略去);

有关信息如下表:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 246 | -33 |
沸点/℃ | 652 | 144 |
其他性质 | 无色晶体,易氧化 | 无色液体,易水解 |
回答下列问题:
(1)甲装置中仪器A的名称为___________。
(2)用甲装置制氯气,MnO4- 被还原为Mn2+,该反应的离子方程式为________________。
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到__________(填现象)后,开始加热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是:
①促进氯气与锡反应;
②_______________________________。
(4)如果缺少乙装置,可能发生的副反应的化学方程式为___________________;己装置的作用是_________________:
A.除去未反应的氯气,防止污染空气
B.防止空气中CO2气体进入戊装置
C.防止水蒸气进入戊装置的试管中使产物水解
D.防止空气中O2进入戊装置的试管中使产物氧化
(5)某同学认为丁装置中的反应可能产生SnCl2杂质,以下试剂中可用于检测是否产生SnCl2 的有_______________(填标号)。
A. H2O2溶液 B. FeCl3溶液(滴有KSCN) C. AgNO3溶液 D. 溴水
(6)反应中用去锡粒1.19g,反应后在戊装置的试管中收集到2.38gSnCl4,则SnCl4的产率为________。(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子中各种化学键如下图所示,

下列关于反应的断键位置的说明错误的是( )
A. 乙醇和乙酸、浓H2SO4共热时断键②
B. 乙醇和金属钠的反应断键①
C. 乙醇和浓H2SO4共热到170℃时断键②⑤
D. 乙醇在Ag催化下与O2反应时断键①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。下列说法正确的是
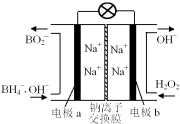
A.电池放电时Na+从b极区移向a极区
B.该电池的负极反应为:BH4-+8OH--8e-===BO2-+6H2O
C.电极a采用MnO2,MnO2既作电极材料又有催化作用
D.每消耗3 mol H2O2,转移的电子为3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.反应在前50 s的平均速率为v(PCl3)=0.0032mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0mol PCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液,有关微粒的物质的量变化如图,根据图示判断,下列说法正确的是( )

A. 在P点时,c(H2A)+c(HA-)+c(A2-)+c(OH-)=c(Na+)+c(H+)
B. 当V(NaOH)=20 mL时,c(OH-)=c(H+)+c(HA-)+2c(H2A)
C. 当V(NaOH)=30 mL时,3c(Na+)=2[c(HA- )+c(A2-)+c(H2A)]
D. 当V(NaOH)=40 mL时,c(Na+)>c(A2-)>c(HA-)>c(H2A)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置干容积为2L的密用容器中发生如下反应:4A(g)+B(g)![]() 2C (g),反皮进行到4s末,测得A、B、C的物质的量分别为0.5mol、0.4mol、0.2mol。则用反应物B表示该反应的速率为
2C (g),反皮进行到4s末,测得A、B、C的物质的量分别为0.5mol、0.4mol、0.2mol。则用反应物B表示该反应的速率为
A. 0.025mol·L-1·s-1c. B. 0.0125 mol·L-1·s-1
C. 0.05 mol·L-1·s-1 D. 0.1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化示意图,下列说法不正确的是

A. 该反应的热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) △H =-92kJ·mol-1
2NH3(g) △H =-92kJ·mol-1
B. 若在反应体系中加入高效催化剂,E1、E2和△H均减小
C. 若已知H-H的键能和N-H的键能,可求得N![]() N的键能
N的键能
D. 反应2NH3(g)![]() N2(g)+3H2(g)的△S>0
N2(g)+3H2(g)的△S>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的叙述错误的是
A. 将过量氨气通入CuSO4溶液中可得深蓝色溶液
B. 蛋白质溶于水所得分散系可产生丁达尔效应
C. 硅酸钠溶液与稀盐酸反应可生成硅酸胶体
D. 过量铁粉在氯气中燃烧可生成氯化亚铁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com