
【题目】将气体A、B置干容积为2L的密用容器中发生如下反应:4A(g)+B(g)![]() 2C (g),反皮进行到4s末,测得A、B、C的物质的量分别为0.5mol、0.4mol、0.2mol。则用反应物B表示该反应的速率为
2C (g),反皮进行到4s末,测得A、B、C的物质的量分别为0.5mol、0.4mol、0.2mol。则用反应物B表示该反应的速率为
A. 0.025mol·L-1·s-1c. B. 0.0125 mol·L-1·s-1
C. 0.05 mol·L-1·s-1 D. 0.1 mol·L-1·s-1
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g)![]() 2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是( )
2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是( )

A. 维持温度、容积不变,t1时充入SO3(g)
B. 维持压强不变,t1时升高反应体系温度
C. 维持温度、容积不变,t1时充入一定量Ar
D. 维持温度、压强不变,t1时充入SO3(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某体系内有反应物和生成物5种物质:H2S、S、FeCl3、FeCl2、HCl。已知FeCl3为反应物,则另一反应物是( )
A.H2SB.FeCl2C.SD.HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电池在我们的生活中有着重要的应用,请回答下列问题:
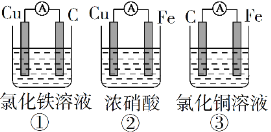
(1)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是______(填序号),写出正极的电极反应式_______。若构建原电池时两个电极的质量相等,当导线中通过0.05mol电子时,两个电极的质量差为________。
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
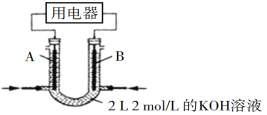
实验测得OH定问移向B电极,则_____(填“A”或“B”)处电极入口通甲烷,其电极反应式为___________。当消耗甲院的体积为33.6 L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,反应后固体物质质量不变的是
A. 在试管中加热小苏打粉末 B. 铝丝插入Cu(NO3)2溶液中
C. 在O2中灼烧Cu2S使之转化为CuO D. 水蒸气通过高温炽热的铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料.回答下列问题:
(1)联氨分子的电子式为___________, 其中氮的化合价为___________.
(2)实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为____________.
(3)①2O2(g)+N2(g)═N2O4(l) △H1
②N2(g)+2H2(g)═N2H4(l) △H2
③O2(g)+2H2(g)═2H2O(g) △H3
④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g) △H4=﹣1048.9kJmol﹣1
上述反应热效应之间的关系式为△H4=______________, 联氨和N2O4可作为火箭推进剂的主要原因为______________________.
(4)联氨为二元弱碱,在水中的电离方式与氨相似.联氨第一步电离反应的平衡常数值为_____ (已知:N2H4+H+N2H5+的K=8.7×107;Kw=1.0×10﹣14).联氨与硫酸形成的酸式盐的化学式为_______________.
(5)联氨是一种常用的还原剂.向装有少量AgBr的试管中加入联氨溶液,观察到的现象是_______________. 联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀.理论上1kg的联氨可除去水中溶解的O2__________kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式,有关反应焓变的判断正确的是( )
C(s)+O2(g)=CO2(g) ΔH1 CO2(g)+C(s)=2CO(g) ΔH2 2CO(g)+O2(g)=2CO2(g) ΔH3
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH4 3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) ΔH5
A. ΔH1>0,ΔH3<0 B. ΔH2>0,ΔH4>0
C. ΔH1=ΔH2+ΔH3 D. ΔH3=ΔH4+ΔH5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列冶炼金属的反应原理,不正确的是
A. 铝热法炼铁:Fe2O3 + 2Al 高温Al2O3 + 2Fe
B. 火法炼铜:Cu2S + O2 高温2Cu + SO2
C. 电解法制钠:2NaCl(熔融) 电解2Na + Cl2↑
D. 电解法制镁:2MgO(熔融) 电解2Mg + O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的用途主要利用了其化学性质的是( )
①酒精用作燃料;②干冰用于人工降雨;③O2用于医疗急救;④稀有气体填充霓虹灯。
A.①③④B.①③C.③④D.②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com