
【题目】以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。下列说法正确的是
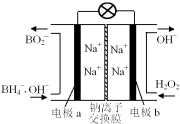
A.电池放电时Na+从b极区移向a极区
B.该电池的负极反应为:BH4-+8OH--8e-===BO2-+6H2O
C.电极a采用MnO2,MnO2既作电极材料又有催化作用
D.每消耗3 mol H2O2,转移的电子为3 mol
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】A(C2H4)是基本的有机化工原料。用A和常见的有机物可合成一种醚类香料和一种缩醛类香料,具体合成路线如图所示(部分反应条件略去):

已知:
回答下列问题:
(1)B的结构简式为____________,C中含有的官能团名称是______________。
(2)若D为单取代芳香族化合物且能与金属钠反应;每个D分子中只含有1个氧原子, D中氧元素的质量分数约为13.1%,则D的结构简式为______________,⑥的反应类型是________________。
(3)写出苯乙醛与新制的银氨溶液反应的离子方程式:___________________。
(4)请写出满足下列条件的苯乙醛的所有同分异构体的结构简式:________________。
i .含有苯环和 ![]() 结构
结构
ii.核磁共振氢谱有4组峰,且峰面积之比为3 : 2 : 2 : 1
(5)若化合物E为苯甲醚的同系物,且相对分子质量比苯甲醚大14,则能使FeCl3溶液显色的E的所有同分异构体共有(不考虑立体异构)__________种。
(6)参照 的合成路线,写出由2-氯丙烷和必要的无机试剂制
的合成路线,写出由2-氯丙烷和必要的无机试剂制 的合成流程图:___________________。合成流程图示例如下:CH2=CH2
的合成流程图:___________________。合成流程图示例如下:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:①稀硫酸 ②小苏打 ③氨水 ④二氧化碳 ⑤FeCl3固体 ⑥稀NaOH溶液 ⑦硝酸亚铁溶液。
(1)上述物质中属于电解质的物质序号为______ 。
(2)有两种物质发生反应的离子方程式为:H++OH-=H2O,这两种物质的序号是______。
(3)加入盐酸、NaOH溶液均能发生化学反应的物质序号为______。
(4)能导电的物质序号为_______________。
(5)④与⑥充分反应后,将溶液小火蒸干,得到固体混合物。固体组成成分可能是(用化学式表示)___________________________。
(6)实验室用⑤制备胶体的化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可降解聚合物P的合成路线如下

(1)A的含氧官能团名称是____________。
(2)羧酸a的电离方程是________________。
(3)B→C的化学方程式是_____________。
(4)化合物D苯环上的一氯代物有2种,D的结构简式是___________。
(5)E→F中反应①和②的反应类型分别是___________。
(6)F的结构简式是_____________。
(7)聚合物P的结构简式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. NaCl(aq) ![]() Cl2
Cl2![]() 漂白粉
漂白粉
B. (C6H10O5)n(淀粉) ![]() C6H12O6(葡萄糖)
C6H12O6(葡萄糖) ![]() C2H5OH
C2H5OH
C. NH3·H2O![]() (NH4)2SO3
(NH4)2SO3![]() (NH4)2SO4
(NH4)2SO4
D. Fe2O3(s) 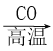 Fe(s)
Fe(s) ![]() FeCl3(aq)
FeCl3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中微粒的物质的量浓度关系正确的是
A. 25℃时,向0.1mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
B. 25℃时,NaB溶液的pH=8,c(Na+)- c(B-)=9.9×10-7 mol·L-1
C. 0.1 mol·L-1NaHCO3溶液:c(Na+)>c(oH-)>c(HCO3-)>c(H+)
D. 相同物质的量浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向25mL0.1mol/LMOH 溶液中逐滴加入0.2mol/LHA 溶液,曲线如图所示(体积变化忽略不计)。回答下列问题

(1)写出MOH 的电离方程式_______;
(2)HA为_______(“强”或“弱”)酸,理由是_______;HA的电离平衡常数为_______;
(3)D点时,溶液中c(A)+c(HA) _______2c(M+) (填“>”“<”或“=”); 溶液中离子浓度大小关系为_______;若此时测得混合溶液的pH=3,则c(HA)+c(H+)=_______mol/L。(准确值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气(主要污染物SO2、NOx)是大气主要污染物,有效去除大气中的SO2、NOx是环境保护的重要课题。
(1) 用天然碱生产小苏打的母液(主要溶质为碳酸钠)吸收烟气中SO2的相关反应的热化学方程式如下:
2Na2CO3(aq)+SO2(g)+H2O(l)===Na2SO3(aq)+2NaHCO3(aq)ΔH=a kJ·mol-1
2NaHCO3(aq)+SO2(g)===Na2SO3(aq)+2CO2(g)+H2O(l)ΔH=b kJ·mol-1
Na2SO3(aq)+SO2(g)+H2O(l)===2NaHSO3(aq)ΔH=c kJ·mol-1
反应Na2CO3(aq)+SO2(g)===Na2SO3(aq)+CO2(g)的ΔH=________kJ·mol-1。
(2) 用碳酸钠溶液吸收NO2的过程会产生NaNO2和NaNO3,写出相关化学反应方程式:__________________________________________________。
(3) 工业上用电解法治理亚硝酸盐对水体的污染,模拟工艺如图所示,写出电解时铁电极发生的电极反应式:__________________________。随后,铁电极附近有无色气体产生,写出有关反应的离子方程式:__________________________________________。

(4) 工业上以钛基氧化物涂层材料为阳极、碳纳米管修饰的石墨为阴极,电解硝酸钠和硫酸钠混合溶液,可使NO3-变为NH4+。电极(电催化剂)所处的环境对其催化活性和选择性均起到重要作用。
①其他条件不变,向其中一份电解液中投加一定量NaCl,去除NH4+的效果明显提高,溶液中氮元素含量显著降低。可能原因是______________________________________________。
②其他条件不变,只改变溶液的pH,NO3-去除率如图所示,pH升高时,去除率________,可能原因是______________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明:丰富的CO2可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)枯竭危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)目前工业上有一种方法是用CO2加氢合成低碳烯烃。现以合成乙烯(C2H4)为例、该过程分两步进行:
第一步:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H =+41.3kJ·mol-1
CO(g)+H2O(g) △H =+41.3kJ·mol-1
第二步:2CO(g)+4H2(g)![]() C2H4(g)+2H2O(g) △H =-210.5kJ·mol-1
C2H4(g)+2H2O(g) △H =-210.5kJ·mol-1
①CO2加氢合成乙烯的热化学方程式为_____________________________。
②一定条件下的密闭容器中,上述反应达到平衡后,要加快反应速率并提高CO2的转化率,可以采取的措施是______(填字母)。
A.减小压强 B.增大H2浓度 C.加入适当催化剂 D.分离出水蒸气
(2)另一种方法是将CO2和H2在230℃催化剂条件下生成甲醇蒸气和水蒸气。现在10L恒容密闭容器中投入1molCO2和2.75molH2,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。在不同条件下测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
CH3OH(g)+H2O(g)。在不同条件下测得平衡时甲醇的物质的量随温度、压强的变化如图所示:

①能判断该反应达到化学平衡状态的是_______(填字母)。
a.c(H2):c(CH3OH)=3:1 b.容器内氢气的体积分数不再改变
C.容器内气体的密度不再改变 d.容器内压强不再改变
②上述反应的△H______0(填“>”或“<”),图中压强p1____p2(填“>”或“<”)。
③经测定知Q点时容器的压强是反应前压强的9/10,则Q点H2的转化率为____________。
④N点时,该反应的平衡常数K=______(计算结果保留两位小数)。
(3)用生石灰吸收CO2可生成难溶电解质CaCO3,其溶度积常数Ksp=2.8×10-9。现有一物质的量浓度为2×10-4mol/L纯碱溶液,将其与等体积的CaCl2溶液混合,则生成沉淀所需CaCl2溶液的最小浓度为___mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com