
【题目】氰化钠(NaCN)是一种重要化工原料,用于化学合成、电镀、冶金等方面.NaCN有剧毒,含氰废水需经无害化处理才能排放,某电镀厂含氰废水的一种工业处理流程如下: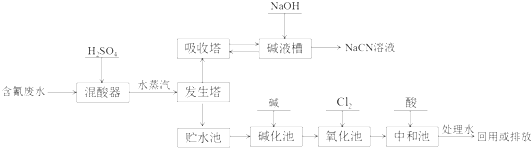
已知:HCNO的结构式是:H﹣O﹣C≡N
HCN的Ka=6.02×10﹣10
[Ag(CN)2]﹣(aq)Ag+(aq)+2CN﹣(aq) K=1.3×10﹣21
回答下列问题:
(1)CN﹣中两原子均为8电子稳定结构,请写出CN﹣的电子式 .
(2)氰化钠遇水会产生剧毒氢氰酸,请写出相应的离子方程式 .
(3)向发生塔中通水蒸汽的目的是 .
(4)氧化池中氰化物的降解分两步进行,CN﹣被氯气氧化成低毒的CNO﹣ , 写出相应的离子方程式 , CNO﹣被氯气氧化成无毒的两种气体,写出相应的离子方程式
(5)贮水池中废水须先经碱化后再进行氧化的原因 .
(6)电镀厂电镀银时需要降低镀层金属的沉积速度,使镀层更加致密.电解液使用Na[Ag(CN)2],请写出阴极反应式 , 解释工业电镀中使用氰离子(CN﹣)的原因 .
【答案】
(1)![]()
(2)CN﹣+H2O?HCN+OH﹣
(3)促使HCN挥发进入吸收塔
(4)CN﹣+Cl2+2OH﹣=CNO﹣+2Cl﹣+H2O;2CNO﹣+3Cl2+4OH﹣═N2↑+CO2↑+6Cl﹣+2H2O
(5)防止生成HCN
(6)[Ag(CN)2]﹣+e﹣=Ag+2CN﹣;Ag+和CN﹣可以结合成稳定的络合物,可以控制银离子浓度,使镀层致密
【解析】解:(1)CN﹣中各原子均满足8电子稳定结构,存在C≡N键,电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;(2)氰化钠易发生水解产生氰化氢,方程式为CN﹣+H2OHCN+OH﹣ , 所以答案是:CN﹣+H2OHCN+OH﹣;(3)向发生塔中通水蒸汽的目的是促使HCN挥发进入吸收塔,所以答案是:促使HCN挥发进入吸收塔;(4)CN﹣被氯气氧化成低毒的CNO﹣ , 同时得到还原产物氯离子,即CN﹣+Cl2+2OH﹣=CNO﹣+2Cl﹣+H2O;CNO﹣被氯气氧化成无毒的两种气体是氮气和二氧化碳,即2CNO﹣+3Cl2+4OH﹣=N2↑+CO2↑+6Cl﹣+2H2O;所以答案是:CN﹣+Cl2+2OH﹣=CNO﹣+2Cl﹣+H2O;2CNO﹣+3Cl2+4OH﹣=N2↑+CO2↑+6Cl﹣+2H2O;(5)贮水池中废水须先经碱化后再进行氧化,这样可以防止生成HCN,所以答案是:防止生成HCN;(6)电解池中,电解液使用Na[Ag(CN)2],在阴极上发生得电子的还原反应,即:[Ag(CN)2]﹣+e﹣=Ag+2CN﹣ , 工业电镀中使用氰离子,这样Ag+和CN﹣可以结合成稳定的络合物,可以控制银离子浓度,使镀层致密,所以答案是:[Ag(CN)2]﹣+e﹣=Ag+2CN﹣;Ag+和CN﹣可以结合成稳定的络合物,可以控制银离子浓度,使镀层致密.
;(2)氰化钠易发生水解产生氰化氢,方程式为CN﹣+H2OHCN+OH﹣ , 所以答案是:CN﹣+H2OHCN+OH﹣;(3)向发生塔中通水蒸汽的目的是促使HCN挥发进入吸收塔,所以答案是:促使HCN挥发进入吸收塔;(4)CN﹣被氯气氧化成低毒的CNO﹣ , 同时得到还原产物氯离子,即CN﹣+Cl2+2OH﹣=CNO﹣+2Cl﹣+H2O;CNO﹣被氯气氧化成无毒的两种气体是氮气和二氧化碳,即2CNO﹣+3Cl2+4OH﹣=N2↑+CO2↑+6Cl﹣+2H2O;所以答案是:CN﹣+Cl2+2OH﹣=CNO﹣+2Cl﹣+H2O;2CNO﹣+3Cl2+4OH﹣=N2↑+CO2↑+6Cl﹣+2H2O;(5)贮水池中废水须先经碱化后再进行氧化,这样可以防止生成HCN,所以答案是:防止生成HCN;(6)电解池中,电解液使用Na[Ag(CN)2],在阴极上发生得电子的还原反应,即:[Ag(CN)2]﹣+e﹣=Ag+2CN﹣ , 工业电镀中使用氰离子,这样Ag+和CN﹣可以结合成稳定的络合物,可以控制银离子浓度,使镀层致密,所以答案是:[Ag(CN)2]﹣+e﹣=Ag+2CN﹣;Ag+和CN﹣可以结合成稳定的络合物,可以控制银离子浓度,使镀层致密.


科目:高中化学 来源: 题型:
【题目】保证食品安全、保持营养均衡,是保障人体健康的基础.
①维生素C能促进人体生长发育.下列富含维生素C的是(填字母).
A.牛肉 B.辣椒 C.鸡蛋
②缺乏某种微量元素将导致甲状腺肿大,且造成智力损害,该微量元素是
A.碘 B.铁 C.钙
③使用青霉素可能会产生过敏,在用药前患者一定要进行 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可利用图所示电解装置吸收和转化SO2(A,B均为惰性电极).下列说法正确的是( ) 
A.A电极接电源的正极
B.A极区溶液的碱性逐渐增强
C.本装置中使用的是阴离子交换膜
D.B极的电极反应式为SO2+2e﹣+2H2O═SO ![]() +4H+
+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断下列盐溶液的酸碱性,能发生水解的用离子方程式表示,不能发生水解的请写上“不发生水解”字样.K2CO3溶液呈性;
K2SO4溶液呈性;
FeCl3溶液呈性 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作叙述正确的是( )
A. 萃取操作必须在漏斗中进行
B. 振荡试管中液体时,手拿住试管,用手腕甩动
C. 用剩的药品应收集起来,放回原试剂瓶中
D. 称量物质时,先取小砝码,再依次取较大的砝码
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国宋代《梦溪笔谈》中记叙了胆矾和铜的炼制过程:“信州铅山县有苦泉,煮之则得胆矾。熬胆矾铁釜,久之亦化为铜。”该炼制过程中没有涉及到的变化是( )
A. 复分解反应B. 氧化还原反应C. 置换反应D. 蒸发结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物E是制备镇静药安宁G的中间体,E和G的两种合成路线如下.(部分反应条件已略去)
已知: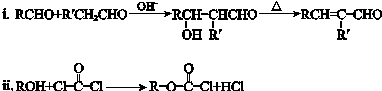
回答下列问题:
(1)A中所含官能团的名称是 , 检验该分子中官能团的常用试剂是 .
(2)A与C含有相同的官能团,B生成C的反应类型是 .
(3)C生成D的化学方程式是 .
(4)试剂a是 .
(5)下列说法正确的是 . a.E能发生取代反应、氧化反应和消去反应 b.M与K是同系物 c.1mol K能跟2molNaOH发生反应
(6)G的结构简式是 .
(7)在一定条件下E还能跟COCl2发生聚合反应生成高分子化合物,该反应的化学方程式是 .
(8)G的同分异构体P,分子中含有“ ![]() ”结构,P的核磁共振氢谱有5组峰,P能水解生成CH3CH2NH2和甲,1mol甲跟足量钠反应生成2mol H2 . 则P的结构简式是 .
”结构,P的核磁共振氢谱有5组峰,P能水解生成CH3CH2NH2和甲,1mol甲跟足量钠反应生成2mol H2 . 则P的结构简式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水系锂电池具有安全、环保和价格低廉等优点成为当前电池研究领域的热点.以钒酸钠(NaV3O8)为正极材料的电极反应式为:NaV3O8+xLi++xe﹣═NaLixV3O8 , 则下列说法不正确的是( ) 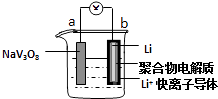
A.放电时,该电池的总反应为:xLi+NaV3O8═NaLixV3O8
B.充电过程中Li+从阳极向阴极迁移
C.充电过程中阳极的电极反应式为NaLixV3O8﹣xe﹣═NaV3O8+xLi+ , NaLixV3O8中钒的化合价发生变化
D.该电池可以用硫酸钠溶液作电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素,周期表的全部元素中X的原子半径最小,X与R的最外层电子数相等;Z的内层电子数是最外层电子数的一半,U的最高化合价和最低化合物的代数和为6;R和Q可形原子数之比为1:1和2:1的两种化合物;R、T、U三者的最高价氧化物对应的水化物两两之间能发生化学反应.请回答下列问题:
(1)T元素在期表中的位置是________;由上述元素中的四种元素形成的既含有离子键又含有共价键的化合物为________(写出其中一种物质的名称).
(2)X、Z、Q三种元素的原子半径由小到大顺序为________(填元素符号).
(3)T、U两元素最高价氧化物对应的水化物反应的离子方程式为________.
(4)下列可以判断R和T金属性强弱的是________(填序号).
a.单质的熔点R比T低 b.单质与酸反应时,失电子数R比T少
c.单质与水反应R比T剧烈 d.最高价氧化物的水化物的碱性R比T强
(5)某同学用Q、R两元素的单质反应生成固体物质R2Q2,R2Q2属于离子化合物,且能与化合物X2Q反应生成Q的单质.R2Q2的电子式为________;R2Q2与X2Q反应的化学方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com