
【题目】下列实验操作叙述正确的是( )
A. 萃取操作必须在漏斗中进行
B. 振荡试管中液体时,手拿住试管,用手腕甩动
C. 用剩的药品应收集起来,放回原试剂瓶中
D. 称量物质时,先取小砝码,再依次取较大的砝码
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
主族周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在③~⑦元素中,原子半径最大的是______,其离子的原子结构示意图为______________。
(2)元素的最高价氧化物对应的水化物中酸性最强的是____________,碱性最强的是____________,呈两性的氢氧化物是________________。
(3)按要求写出下列两种物质的电子式:①的氢化物__________________;⑨的最高价氧化物对应的水化物_______________________;
(4)在⑦与⑩的单质中,化学性质较活泼的是______,可用什么化学反应说明该事实(写出反应的化学方程式) :__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示: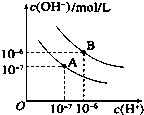
(1)则25℃时水的电离平衡曲线应为(填“A”或“B”),请说明理由
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施是为了降低化学反应速率的是( )
A.铁粉代替铁钉与稀硫酸反应制取氢气
B.双氧水制氧气时加入少量二氧化锰
C.镁和水反应时,适当进行加热
D.食品放在冰箱中贮藏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠(NaCN)是一种重要化工原料,用于化学合成、电镀、冶金等方面.NaCN有剧毒,含氰废水需经无害化处理才能排放,某电镀厂含氰废水的一种工业处理流程如下: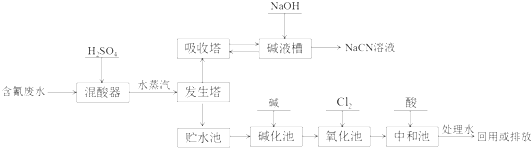
已知:HCNO的结构式是:H﹣O﹣C≡N
HCN的Ka=6.02×10﹣10
[Ag(CN)2]﹣(aq)Ag+(aq)+2CN﹣(aq) K=1.3×10﹣21
回答下列问题:
(1)CN﹣中两原子均为8电子稳定结构,请写出CN﹣的电子式 .
(2)氰化钠遇水会产生剧毒氢氰酸,请写出相应的离子方程式 .
(3)向发生塔中通水蒸汽的目的是 .
(4)氧化池中氰化物的降解分两步进行,CN﹣被氯气氧化成低毒的CNO﹣ , 写出相应的离子方程式 , CNO﹣被氯气氧化成无毒的两种气体,写出相应的离子方程式
(5)贮水池中废水须先经碱化后再进行氧化的原因 .
(6)电镀厂电镀银时需要降低镀层金属的沉积速度,使镀层更加致密.电解液使用Na[Ag(CN)2],请写出阴极反应式 , 解释工业电镀中使用氰离子(CN﹣)的原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离或水解方程式书写不正确的是( )
A.碳酸氢钠的电离方程式为:NaHCO3═Na++HCO ![]() ?? HCO
?? HCO ![]() ?H++CO
?H++CO ![]()
B.偏铝酸钠的水解方程式为:AlO2﹣+2H2O═Al(OH)3↓+OH﹣
C.硫化铝溶于水的水解方程式为:Al2S3+6H2O═2Al(OH)3↓+3H2S↑
D.醋酸铵的水解方程式为:CH3COO﹣+NH ![]() +H2O?CH3COOH+NH3?H2O
+H2O?CH3COOH+NH3?H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生命健康密切相关,“84”消毒液(有效成分为 NaClO)在抗击新冠肺炎疫情中起到重要作用。下列说法错误的是
A.“84”消毒液为混合物
B.“84”消毒液具有漂白性
C.“84”消毒液可用于灭杀新型冠状病毒
D.“84”消毒液可以与“洁厕灵”(主要成分为盐酸)混用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁酸钾晶体(K3[Fe(C2O4)3]xH2O)是一种光敏材料,在110℃可完全失去结晶水.为测定该晶体中铁的含量,某实验小组做了如下实验:铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液.
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO ![]() 被还原成Mn2+ . 向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性.
被还原成Mn2+ . 向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO ![]() 被还原成Mn2+ . 重复步骤二、步骤三操作,滴定消耗0.010mol/L KMnO4溶液分别为19.98mL和20.00mL.请回答下列问题:
被还原成Mn2+ . 重复步骤二、步骤三操作,滴定消耗0.010mol/L KMnO4溶液分别为19.98mL和20.00mL.请回答下列问题:
(1)滴定过程中,高锰酸钾应盛装在滴定管中(填“酸式”或“碱式”).
(2)用离子方程式表示步骤二中涉及到的相关化学反应:;Zn+2Fe3+═2Fe2++Zn2+ .
(3)步骤三中滴定终点的判定: .
(4)在步骤二中,若加入的KMnO4溶液的量不够,则测得的铁含量 . 在步骤三中,若滴定前仰视读数,滴定后俯视读数,则测得的铁含量 . (选填“偏低”、“偏高”、“不变”)
(5)实验测得该晶体中铁的质量分数为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com