
【题目】下列电离或水解方程式书写不正确的是( )
A.碳酸氢钠的电离方程式为:NaHCO3═Na++HCO ![]() ?? HCO
?? HCO ![]() ?H++CO
?H++CO ![]()
B.偏铝酸钠的水解方程式为:AlO2﹣+2H2O═Al(OH)3↓+OH﹣
C.硫化铝溶于水的水解方程式为:Al2S3+6H2O═2Al(OH)3↓+3H2S↑
D.醋酸铵的水解方程式为:CH3COO﹣+NH ![]() +H2O?CH3COOH+NH3?H2O
+H2O?CH3COOH+NH3?H2O
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、H、I均是由短周期元素组成的中学常见物质,B、D、E、G为单质,F是一种常见的金属氧化物.A为氯碱工业的产物之一,B元素是地壳中含量最高的金属元素,C是一种无色无味的液体,D是一种新型能源物质,这些物质的转化关系如下(反应条件已略去,反应物与生成物都已保留在图中).
请回答下列问题:
(1)A中所含化学键的名称为;物质I的电子式为 .
(2)写出②的离子反应方程式 .
(3)若G为实验室中常用来催化乙醇氧化为乙醛的物质,则F为(写化学式).
(4)若G为第四周期过渡元素,F与B的混合物常用于铁路上焊接铁轨.写出G与C在一定条件下反应的化学方程式 .
(5)25°C时,pH均为10的A、H两瓶溶液中,由水电离出来的氢氧根离子浓度之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各溶液中,微粒的物质的量浓度关系正确的是( )
A.1.0 mol/L Na2CO3溶液:c(OH﹣)=c(HCO ![]() )+c(H+)+2c(H2CO3)
)+c(H+)+2c(H2CO3)
B.1.0 mol/L NH4Cl溶液:c(NH ![]() )=c(Cl﹣)
)=c(Cl﹣)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
D.1 mol/L CH3COONa溶液,c(CH3COO﹣)=1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作叙述正确的是( )
A. 萃取操作必须在漏斗中进行
B. 振荡试管中液体时,手拿住试管,用手腕甩动
C. 用剩的药品应收集起来,放回原试剂瓶中
D. 称量物质时,先取小砝码,再依次取较大的砝码
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.将废弃的含铅、汞电子产品掩埋地下,防止污染环境
B.大力发展氢能源汽车减少碳排放
C.控制卤代烃的使用,减少对臭氧层的破坏
D.大力发展核能,减少化石能源的使用,有利于保护环境
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物E是制备镇静药安宁G的中间体,E和G的两种合成路线如下.(部分反应条件已略去)
已知: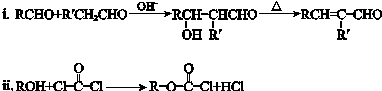
回答下列问题:
(1)A中所含官能团的名称是 , 检验该分子中官能团的常用试剂是 .
(2)A与C含有相同的官能团,B生成C的反应类型是 .
(3)C生成D的化学方程式是 .
(4)试剂a是 .
(5)下列说法正确的是 . a.E能发生取代反应、氧化反应和消去反应 b.M与K是同系物 c.1mol K能跟2molNaOH发生反应
(6)G的结构简式是 .
(7)在一定条件下E还能跟COCl2发生聚合反应生成高分子化合物,该反应的化学方程式是 .
(8)G的同分异构体P,分子中含有“ ![]() ”结构,P的核磁共振氢谱有5组峰,P能水解生成CH3CH2NH2和甲,1mol甲跟足量钠反应生成2mol H2 . 则P的结构简式是 .
”结构,P的核磁共振氢谱有5组峰,P能水解生成CH3CH2NH2和甲,1mol甲跟足量钠反应生成2mol H2 . 则P的结构简式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将一包白色无水硫酸铜粉末投入到150g蒸馏水中,充分搅拌过滤得到一定质量的蓝色晶体和84g滤液.又知此温度下无水硫酸铜的溶解度为40g,则此包无水硫酸铜的质量是( )
A.60 g
B.66 g
C.90 g
D.184 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】著名的“侯氏制碱法”的第一步反应是向饱和食盐水中通入CO2而析出NaHCO3 , 该反应可表示为:NH3+NaCl+CO2+H2O═NaHCO3↓+NH4Cl
已知NaCl、NaHCO3、NH4Cl如下温度的溶解度:
物质 | NaCl | NaHCO3 | NH4Cl |
40℃时溶解度/g | 37 | 13 | 46 |
10℃时溶解度/g | 33 |
今在40℃时,向434g饱和食盐水中通入44.8L(标准状况)NH3 , 再向溶液中通入过量的CO2 , 求:
(1)可析出NaHCO3多少克?
(2)NH4Cl能否析出?
(3)若降温至10℃,可析出NH4Cl多少克?
(4)降温至10℃时,若要析出更多的NH4Cl晶体应采取什么措施?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃、101 kPa的条件下,断裂1 mol H—H键吸收436 kJ能量,断裂1 mol Cl—Cl键吸收243 kJ能量,形成1 mol H—Cl键放出431 kJ能量。H2+Cl2===2HCl的化学反应可用下图表示:
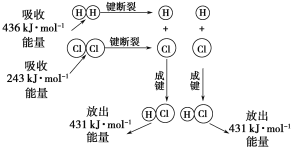
请回答下列有关问题:
(1)反应物断键吸收的总能量为________。
(2)生成物成键放出的总能量为________。
(3)判断H2+Cl2===2HCl是________(填“吸收”或“放出”)能量。
(4)反应物的总能量________(填“>”,“=”或“<”)生成物的总能量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com