
| ʵ���� | HA���ʵ���Ũ��(mol��L-1) | NaOH���ʵ���Ũ��(mol��L-1) | �����Һ��pH |
| �� | 0.1 | 0.1 | pH��9 |
| �� | c | 0.2 | pH��7 |
| �� | 0.2 | 0.1 | pH��7 |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��pH��2��pH��1��������c(H+)֮�� |
| B��Na2CO3��Һ��c(Na+)��c(CO32�� )֮�� |
| C��0.2mol/L��0.1mol/L������c(H+)֮�� |
| D��NO2����ˮʱ����������n(NO2)�뱻��ԭ��n(NO2)֮��Ϊ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��ij������Һ��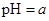 ��������Һϡ��1������Һ�� ��������Һϡ��1������Һ��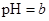 ���� ����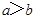 |
| B����2.0mLŨ�Ⱦ�Ϊ0��1 mol��L-1��KCl��KI���Һ�е�1��2��0��01 mol��L-1 AgNO3��Һ���������ʻ�ɫ��˵��AgCl��Ksp��AgI��KspС |
| C��0��2 mol/L��һԪ��HX��0��1 mol/L��KOH��Һ��������������Һ�У� һ���У�c��H+��+ c��K+���� c��OH����+ c��X���� |
| D�������£�0��2 mol?L��1����������0��05 mol?L��1 Ba��OH��2��Һ��Ϻ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
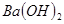 ��Һ�У���μ���һ�����ʵ���Ũ�ȵ�
��Һ�У���μ���һ�����ʵ���Ũ�ȵ�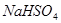 ��Һ������Һ�е�
��Һ������Һ�е�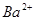 ǡ����ȫ����ʱ����Һ
ǡ����ȫ����ʱ����Һ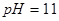 ������Ӧ����Һ���������
������Ӧ����Һ���������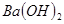 ��Һ��
��Һ��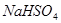 ��Һ�����֮�ͣ���
��Һ�����֮�ͣ���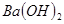 ��Һ��
��Һ��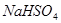 ��Һ���������
��Һ���������| A��1��9 | B��1��1 | C��1��2 | D��1��4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��pH=11��NaOH��Һ��pH=3��CH3COOH��Һ�������� |
| B��0.1mol��L-1�����0.1mol��L-1��ˮ�������� |
| C��0.1mol��L-1��ˮ��0.1mol��L-1��ˮ���Һ�������� |
| D��һ�����pH=5��ϡ�����ˮϡ��103�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��c(OH��) = 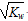 ����Һ ����Һ | B��pH��7 ����Һ |
| C��c(H+) =10��14����Һ | D���Ӽ��ȳʻ�ɫ����Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0��5 mol��L | B��2 mol��L | C��l mol��L | D����ȷ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

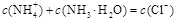
| | ����Ũ�ȵĹ�ϵ | ���� | ��Һ��pH | �����غ��ϵ |
| �� | C��NH4+����C��Cl-����C��OH-����C��H+�� | | pH��7 | / |
| �� | | NH4Cl | / | |
| �� | C��Cl-����C��H+����C��NH4+����C��OH-�� | | pH��7 | / |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ס�������Һ��pH��������ͬ |
| B���ס���������Һ�м���Al�۶������H2 |
| C��HCO�������ڼס�������Һ�д������� |
| D���ײ�����������Һ���Ҳ�������������Һ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com