
【题目】全氮类物质因具有超高能量而成为超高含能材料的典型代表。我国科学家成功合成了全氮阴离子盐——(N5)6(H3O)3(NH4)4Cl,是该领域的重大突破。
(1)氮的原子结构示意图为________。
(2)构成该全氮阴离子盐的离子是Cl-、H3O+、NH4+和________。
(3)氯与氢之间的作用对全氮阴离子盐的稳定性起着至关重要的作用。结合原子结构解释氯元素非金属性强的原因:________。
【答案】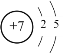 N5- 氯元素的结构示意图为
N5- 氯元素的结构示意图为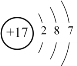 ,最外层得到1个电子,达到稳定结构
,最外层得到1个电子,达到稳定结构
【解析】
(1)氮元素位于第二周期VA族,根据核外电子排布规律进行分析;
(2)利用电荷守恒进行分析;
(3)利用氯原子的结构示意图进行分析;
(1)氮原子位于第二周期第VA族,氮的原子结构示意图为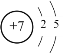 ;
;
答案为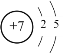 ;
;
(2) 构成该全氮阴离子盐的离子是Cl-、H3O+、NH4+,根据全氮阴离子盐的化学式,以及呈现电中性,推出另外一种离子是N5-;
答案为N5-;
(3)氯元素的结构示意图为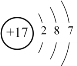 ,最外层得到1个电子,达到稳定结构,因此氯原子容易得到1个电子,表现出很强的非金属性;
,最外层得到1个电子,达到稳定结构,因此氯原子容易得到1个电子,表现出很强的非金属性;
答案为氯元素的结构示意图为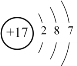 ,最外层得到1个电子,达到稳定结构。
,最外层得到1个电子,达到稳定结构。


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】黄铜矿是工业炼铜的原料,含有的主要元素是硫、铁、铜,请回答下列问题。
(l)基态硫原子中核外电子有____种空间运动状态。Fe2+的电子排布式是 ___。
(2)液态SO2可发生白偶电离2SO2=SO2++SO32-,SO32-的空间构型是 ___,与SO2+互为等电子体的分子有____(填化学式,任写一种)。
(3)CuCl熔点为426℃,融化时几乎不导电,CuF的熔点为908℃,沸点1100℃,都是铜(I)的卤化物,熔沸点相差这么大的原因是 ___。
(4)乙硫醇(C2H5SH)是一种重要的合成中间体,分子中硫原子的杂化形式是____。乙硫醇的沸点比乙醇的沸点____(填“高”或“低”),原因是____。
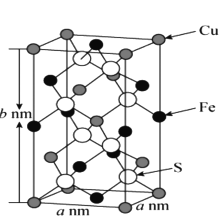
(5)黄铜矿主要成分X的晶胞结构及晶胞参数如图所示,X的化学式是 ___,其密度为 ___g/cm3(阿伏加德罗常数的值用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种制氢技术原理如图所示,下列说法正确的是( )
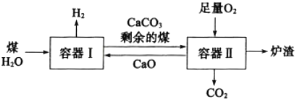
A.向容器Ⅰ中加入CaO能有效实现H2与CO2的分离
B.因为容器Ⅰ中还有剩余的煤,可以判断煤和H2O的反应为可逆反应
C.剩余的煤进入容器Ⅱ,可利用其与O2反应放出的热量分解CaCO3
D.煤中含有的硫元素在容器Ⅱ中最终转化为CaSO3进入炉渣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
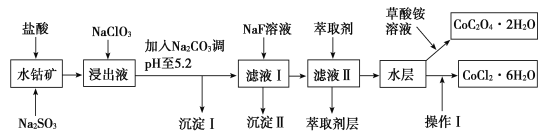
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀Ⅰ中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | 开始沉淀 | 完全沉淀 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Co(OH)2 | 7.6 | 9.2 |
Al(OH)3 | 4.0 | 5.2 |
Mn(OH)2 | 7.7 | 9.8 |
(1)浸出过程中氧化剂与还原剂物质的量之比为___。
(2)NaClO3在浸出液中发生反应的离子方程式为___。
(3)加入Na2CO3调pH至5.2,目的是___;萃取剂层含锰元素,则沉淀Ⅱ的主要成分为__。
(4)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3,___、___、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O的含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是___(回答一条原因即可)。
(6)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
温度范围/℃ | 150~210 | 290~320 |
固体质量/g | 4.41 | 2.41 |
经测定,整个受热过程,只产生水蒸气和CO2气体,则290~320℃温度范围,剩余的固体物质化学式为___。[已知:CoC2O4·2H2O的摩尔质量为183g·mol-1]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y和Z为原子序数依次增大的四种短周期元素。X是短周期原子半径最大的元素,Y的最高化合价与最低价相加为0,Z是同周期非金属性最强的元素,W、X、Y三种元素形成的一种化合物结构如图所示。下列叙述正确的是
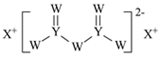
A.X单质的熔点高于Y单质
B.气态氢化物稳定性:Y<Z
C.Z的氧化物对应的水化物为强酸
D.X分别与W、Z形成的二元化合物溶于水显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cl2和Ca(OH)2制备少量漂粉精(一种含氯消毒剂)的装置如下。
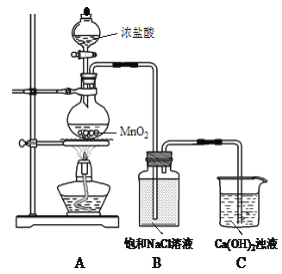
(1)A为氯气发生装置。A中反应方程式是________。
(2)B的作用是吸收挥发出的HCl。HCl可能对制备漂粉精造成的影响是________。
(3)用Cl2和Ca(OH)2制备的漂粉精,其有效成分是_________。
(4)漂粉精常用于游泳池的消毒,起消毒作用的是HClO。漂粉精在水中释放HClO的途径如下:
途径一:Ca(ClO)2 + 2H2O Ca(OH)2 + 2HClO
途径二:Ca(ClO)2 + H2O + CO2 =________+ _______(把反应补充完整)
(5)池水的酸碱性对漂粉精的消毒效果影响明显。
①池水碱性过强,杀毒作用会________(填“增强”或“减弱”)。
②池水酸性过强,会刺激眼睛和皮肤。通常加入Na2CO3、NaHCO3以降低酸性,起到降低酸性作用的离子分别是________(填离子符号)。
(6)某届奥运会期间,发生了室外游泳池水变绿的事件,成为当时的一大新闻。有关负
责人说,池水变绿是藻类生长造成的。该游泳池每隔一段时间就要投放含氯消毒剂,当再次投放时,误投了过氧化氢(H2O2)消毒剂。消毒剂为什么不起作用了?_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类生活离不开化学,以下是补铁剂和胃药的两张标签的部分信息。
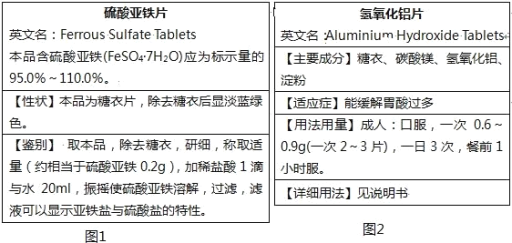
(1)根据“硫酸亚铁片”标签如图1回答:
①硫酸亚铁片中,糖衣的作用是_______;
②检验硫酸亚铁是否被氧化的试剂是_______;
③硫酸盐的鉴别反应的离子方程式是______;
④鉴别中,“加稀盐酸1滴”的作用是_______(选填序号);
A.防止亚铁离子被氧化 B.抑制亚铁离子水解
(2)根据氢氧化铝片标签如图2回答:
①能缓解胃酸过多的有效成分是______;
②写出氢氧化铝中和胃酸反应的离子方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为正盐。根据下列变化进行推断,回答有关问题:

(1)推断A、B、C、D的化学式:A________、B________、C________、D________。
(2)写出下列反应的离子方程式:
反应①生成气体B:__________________________________________________;
反应②白色沉淀溶解:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)若将饱和FeCl3溶液分别滴入下列物质中,能形成胶体的是________(填字母)。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(2)现有甲、乙、丙三名同学进行Fe(OH)3胶体的制备:
①甲同学的操作:取一小烧杯,加入25 mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2 mL FeCl3饱和溶液,继续煮沸至混合液呈红褐色,停止加热。请评价该操作是否正确______。
②乙直接加热饱和FeCl3溶液,请评价是否正确______。
③丙向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟,请评价是否正确________。
(3)写出制备Fe(OH)3胶体的化学方程式: ____________________。证明有Fe(OH)3胶体生成的实验操作是_____________________。该操作利用胶体的性质是________。
(4)Fe(OH)3胶体稳定存在的主要原因是____________________(填字母,下同)。
A.胶体粒子直径小于1nm B.胶体粒子带正电荷
C.胶体粒子作布朗运动 D.胶体粒子能透过滤纸
(5)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是________。
A.Fe(OH)3胶体粒子的直径在1~100 nm之间
B.Fe(OH)3胶体具有丁达尔效应
C.Fe(OH)3胶体是均一的分散系
D.Fe(OH)3胶体的分散质能透过滤纸
(6)若取少量制得的胶体加入试管中,加入硫酸铵溶液,现象是_____________,这种现象称为胶体的________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com