
【题目】用Cl2和Ca(OH)2制备少量漂粉精(一种含氯消毒剂)的装置如下。
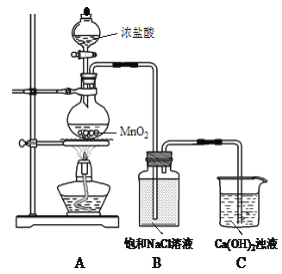
(1)A为氯气发生装置。A中反应方程式是________。
(2)B的作用是吸收挥发出的HCl。HCl可能对制备漂粉精造成的影响是________。
(3)用Cl2和Ca(OH)2制备的漂粉精,其有效成分是_________。
(4)漂粉精常用于游泳池的消毒,起消毒作用的是HClO。漂粉精在水中释放HClO的途径如下:
途径一:Ca(ClO)2 + 2H2O Ca(OH)2 + 2HClO
途径二:Ca(ClO)2 + H2O + CO2 =________+ _______(把反应补充完整)
(5)池水的酸碱性对漂粉精的消毒效果影响明显。
①池水碱性过强,杀毒作用会________(填“增强”或“减弱”)。
②池水酸性过强,会刺激眼睛和皮肤。通常加入Na2CO3、NaHCO3以降低酸性,起到降低酸性作用的离子分别是________(填离子符号)。
(6)某届奥运会期间,发生了室外游泳池水变绿的事件,成为当时的一大新闻。有关负
责人说,池水变绿是藻类生长造成的。该游泳池每隔一段时间就要投放含氯消毒剂,当再次投放时,误投了过氧化氢(H2O2)消毒剂。消毒剂为什么不起作用了?_______。
【答案】MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O HCl能与Ca(OH)2发生反应生成CaCl2和H2O,使Ca(ClO)2浓度降低 Ca(ClO)2 HClO CaCO3 减弱 CO32-、HCO3- HClO具有强氧化性,能将H2O2氧化,HClO+H2O2=HCl+O2↑+H2O
MnCl2+Cl2↑+2H2O HCl能与Ca(OH)2发生反应生成CaCl2和H2O,使Ca(ClO)2浓度降低 Ca(ClO)2 HClO CaCO3 减弱 CO32-、HCO3- HClO具有强氧化性,能将H2O2氧化,HClO+H2O2=HCl+O2↑+H2O
【解析】
根据装置图,装置A为制备氯气,装置B是除去氯气中的HCl,装置C为Cl2与Ca(OH)2反应生成漂粉精,据此分析;
(1)装置A为氯气发生装置,其中反应方程式为MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
答案:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)制取漂粉精的有效成分是Ca(ClO)2,HCl能与Ca(OH)2发生反应生成CaCl2和H2O,使Ca(ClO)2浓度降低;
答案:HCl能与Ca(OH)2发生反应生成CaCl2和H2O,使Ca(ClO)2浓度降低;
(3)Cl2与Ca(OH)2发生2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,其有效成分是Ca(ClO)2;
答案:Ca(ClO)2;
(4)利用碳酸的酸性强于次氯酸,即途径二:Ca(ClO)2+CO2+H2O=HClO+CaCO3;
答案:HClO、CaCO3;
(5)①ClO-在酸性条件下生成HClO,HClO具有强氧化性,即ClO-在碱性过强时,ClO-氧化性减弱,消毒作用减弱;
答案:减弱;
②酸性过强,说明溶液中有大量的H+,CO32-、HCO3-能与H+反应生成CO2和H2O,降低c(H+);
答案:CO32-、HCO3-;
(6)根据题意,再次投放时,误投过氧化氢,HClO具有强氧化性,能将H2O2氧化,即发生反应的是HClO+H2O2=HCl+O2↑+H2O,造成藻类生长;
答案:HClO具有强氧化性,能将H2O2氧化,HClO+H2O2=HCl+O2↑+H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,对可逆反应A(g)+2B(g)![]() 3C(g)的下列叙述中,能说明反应已达到平衡的是( )
3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A. C生成的速率与C分解的速率相等
B. 单位时间内消耗amolA,同时生成3amolC
C. 容器内的压强不再变化
D. 混合气体的物质的量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看做化学平衡。请根据所学的知识回答:
(1)0.1 mol·L-1的NH4Cl溶液,在该溶液中各种离子的浓度由大到小顺序为_________。
(2)0.1 mol·L-1 NaHCO3溶液,请分析NaHCO3溶液显碱性的原因:________。
(3)FeCl3溶液,实验室中配制FeCl3溶液时常加入____________以抑制其水解。
(4)向含有AgI固体的饱和溶液中:
①加入固体AgNO3,则c(I-)_____(填“变大”、“ 变小”或“不变”,下同),c(Ag+)__。
②若改加更多的AgI,则c(Ag+)将____。
③若改加Na2S固体,则c(I-)____,c(Ag+)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用除去表面氧化膜的细铝条紧紧缠绕在温度计上(如图),将少许硝酸汞溶液滴到铝条表面,置于空气中,很快铝条表面产生“白毛”,且温度明显上升。下列分析错误的是

A.Al和O2化合放出热量B.硝酸汞是催化剂
C.涉及了:2Al+3Hg2+→2Al3++3HgD.“白毛”是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全氮类物质因具有超高能量而成为超高含能材料的典型代表。我国科学家成功合成了全氮阴离子盐——(N5)6(H3O)3(NH4)4Cl,是该领域的重大突破。
(1)氮的原子结构示意图为________。
(2)构成该全氮阴离子盐的离子是Cl-、H3O+、NH4+和________。
(3)氯与氢之间的作用对全氮阴离子盐的稳定性起着至关重要的作用。结合原子结构解释氯元素非金属性强的原因:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用硫酸铁溶液与铜粉反应,又向反应后溶液中加入KSCN溶液以检验Fe3+是否有剩余,实验记录如下;
实验编号 | 操作 | 现象 |
实验1 |
| i.加入Cu粉后充分振荡,溶液逐渐变蓝; ii.取少量i中清液于试管中,滴加2滴 0.2mol/LKSCN溶液,溶液变为红色,但振荡后红色迅速褪去并有白色沉淀生成。 |
(1)写出实验1中第i步的离子方程式_______________。甲同学猜想第ii步出现的异常现象是由于溶液中的Cu2+干扰了检验Fe3+的现象。查阅相关资料如下
①2Cu2++4SCN- ![]() 2CuSCN↓(白色)+(SCN)2(黄色)
2CuSCN↓(白色)+(SCN)2(黄色)
②硫氰[(SCN)2]:是一种拟卤素,性质与卤素单质相似,其氧化性介于Br2和I2之间。
该同学又通过如下实验验证猜想
实验编号 | 操作 | 现象 |
实验2 |
| 溶液呈绿色,一段时间后后开始出现白色沉淀,上层溶液变为黄色 |
实验3 |
| 无色溶液立即变红,同时生成白色沉淀。 |
(2)经检测,实验2反应后的溶液pH值减小,可能的原因是___________________________________________。
(3)根据实验2、3的实验现象,甲同学推断实验3中溶液变红是由于Fe2+被(SCN)2氧化,写出溶液变红的离子方程式_______________________。继续将实验2中的浊液进一步处理,验证了这一结论的可能性。
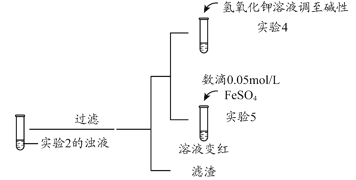
补充实验4的目的是排除了溶液存在Cu2+的可能,对应的现象是____________________________________________。
(4)乙同学同时认为,根据氧化还原反应原理,在此条件下,Cu2+也能氧化Fe2+,他的判断依据是_______。
(5)为排除干扰,小组同学重新设计如下装置。
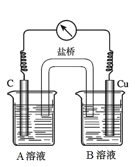
①A溶液为____________________________。
②“电流表指针偏转,说明Cu与Fe3+发生了反应”,你认为这种说法是否合理?__________________(填合理或不合理),原因是__________________________________________。
③验证
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾中FeSO4·7H2O含量的测定,若用容量法测定绿矾中FeSO4·7H2O的含量。滴定反应是:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。
实验方案如下:①称取15.041g绿矾产品,溶解,在250mL容量瓶中定容。
②量取25.00mL 待测溶液于锥形瓶中。
③用0.0500mol/LKMnO4溶液(硫酸酸化)滴定至终点,记录初读数和末读数。
④ 。
⑤ 数据处理。
(1)上述实验方案中的步骤④是______。洁净的滴定管在滴定前必须进行的操作有:
①检验活塞是否漏水;
②_______;
③向滴定管中加入KMnO4标准溶液到0刻度以上,赶走尖嘴部位的气泡,调节初读数。
(数据处理)某小组同学的实验数据记录如下:
实验次数 | 初读数(mL) | 末读数(mL) |
1 | 0.20 | 21.40 |
2 | 0.00 | 21.00 |
3 | 1.60 | 26.60 |
(2)上述样品中FeSO4·7H2O的质量分数为_______(用小数表示,保留三位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2 mol A与2 mol B混合于2L的密闭容器中,发生如下反应:2A(g)+3B(g) ![]() 2C(g)+zD(g);若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
2C(g)+zD(g);若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
A.v(C)=v(D)=0.2 mol·L-1·s-1
B.z=3
C.B的转化率为75%
D.反应前与2 s后容器的压强比为4∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
A.MgCO3![]() MgCl2(aq)
MgCl2(aq) ![]() Mg
Mg
B.Cu2(OH)2CO3![]() CuO
CuO![]() Cu(OH)2
Cu(OH)2
C.BrCH2COOH![]() HOCH2COOH
HOCH2COOH![]() H-[OCH2CO]n-OH
H-[OCH2CO]n-OH
D.NH3![]() NO
NO![]() HNO3
HNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com