
某溶液中含有Cl-和I-的物质的量浓度相同。为了氧化I-而不使Cl-氧化,试根据下列三个反应判断,可选用的氧化剂是:①2Fe3++2I-=2Fe2++I2 ②2Fe2++Cl2=2Fe3++2Cl- ③2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O
| A.FeCl2 | B.KMnO4 | C.浓盐酸 | D.FeCl3 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
在5.6 g Fe粉中加入过量的稀硫酸溶液,待反应完全后,再加入1mol·L-1 KNO3溶液25mL,恰好反应完全。该反应的方程式为:
FeSO4 +KNO3 +H2SO4→K2SO4 +Fe2(SO4)3+NxOy + H2O(未配平),则对该反应的下列说法正确的是
| A.化学方程式中按物质顺序的计量数是:8、2、5、1、4、1、5 |
| B.反应中氧化产物是N2O |
| C.反应过程中转移的电子数为8mol电子 |
| D.氧化产物和还原产物的物质的量之比为4∶1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe2++H2O2+2H+=2Fe3++2H2O 2Fe3++H2O2=2Fe2++O2↑+2H+
下列说法不正确的是( )
| A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱 |
| B.在反应过程中,溶液的pH基本不变 |
| C.在反应过程中,Fe2+和Fe3+的总量保持不变 |
| D.H2O2生产过程要严格避免混入Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
Na2FeO4是一种高效多功能水处理剂,应用前景十分看好。一种制备Na2FeO4的方法可用
化学方程式表示如下:2FeSO4 + 6Na2O2= 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑
对此反应下列说法中正确的是( )
| A.Na2O2只作氧化剂 | B.Na2FeO4既是氧化产物又是还原产物 |
| C.O2是还原产物 | D.2 mol FeSO4发生反应时,反应中共有8 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
关于反应3Cl2 + 6KOH 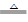 KClO3 + 5KCl + 3H2O,以下说法正确的是
KClO3 + 5KCl + 3H2O,以下说法正确的是
| A.KOH既不是氧化剂,又不是还原剂 |
| B.Cl2是氧化剂,KOH是还原剂 |
| C.3mol氯气参加反应转移6 mol电子 |
| D.被氧化的氯元素的质量为被还原的氯元素质量的5倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
纤维素还原法制取ClO2是将纤维素水解得到的最终产物C6H12O6与NaClO3在酸性条件下反应生成ClO2。下列叙述中正确的是
□C6H12O6+24NaClO3+12H2SO4=24ClO2↑+□CO2↑+18H2O+12Na2SO4
| A.方程式中产物CO2的计量数为6 |
| B.CO2是还原产物,ClO2是氧化产物 |
| C.氧化剂和还原剂的物质的量之比为4:1 |
| D.每生成1 mol CO2需转移24mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知在酸性溶液中的还原性强弱顺序为:SO2 >I–>H2O2>Fe2+>Cl–,下列反应不可能发生的是:
| A.H2O2+ H2SO4=SO2↑+ O2↑+2 H2O |
| B.2I– +2Fe3+=I2+2 Fe2+ |
| C.2Fe3++ SO2 +2H2O=2Fe2++SO42– +4H+ |
| D.SO2 +2 H2O+ I2=H2SO4+2HI |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
| A.60 mL | B.45 mL | C. 30 mL | D. 15 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com