
【题目】某研究小组查阅资料发现Fe3+与I-的反应具有可逆性,推测亚铁盐与饱和碘水的混合液中会存在Fe3+,并据此设计实验1(如下图所示),发现溶液未变红。该小组对溶液未变红的原因进行了如下探究。
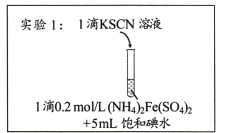
I.初步探究
实验2:用煮沸冷却后的蒸馏水重新配制两种饱和溶液进行实验,实验记录如下表。
编号 | 饱 和 (NH4)2Fe(SO4)2溶液 | 饱和碘水 | 石蜡油 | 操作 | KSCN溶液 | 现象 |
2-1 | 1滴 | 5mL | 1mL | 不加热 | 1滴 | 无明显现象 |
2-2 | 1滴 | 5mL | 1mL | 加热一段时间后冷却 | 1滴 | 无明显现象 |
(1)研究小组同学根据所查阅资料写出的Fe3+与I-反应的离子方程式为____。
(2)实验2中,加入石蜡油的目的是____。
(3)小组同学做出推断:反应速率不是导致实验1中溶液未变红的主要原因,他们的理由是___。
II.查阅资料,继续探究
(资料)AgSCN为不溶于水的白色固体。
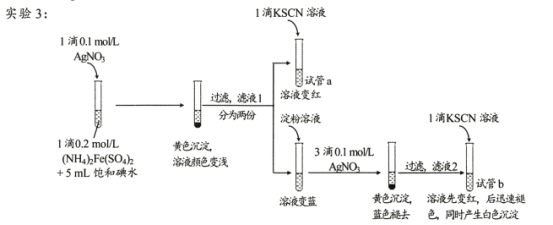
(4)试管a的实验现象说明滤液l中含有____。
(5)试管b中,加入KSCN溶液后所产生实验现象的原因是 ___。
(6)甲同学对实验3提出了质疑,认为其实验现象并不能证明I2氧化了Fe2+。他提出如下假设:i.可能是AgNO3氧化了Fe2+;ii.可能是空气中的O2氧化了Fe2+。 他设计、实施了实验4,实验记录如下表。
编号 | 实验操作 | 实验现象 |
4 | 在试管中加入1滴0.2mol/L(NH4)2Fe(SO4)2溶液,5mL蒸馏水,1滴试剂a,一段时间后加入1滴KSCN溶液 | 溶液不变红 |
①试剂a是 ___。
②依据实验4,甲同学做出判断:______________________
(7)根据实验1~4所得结论是____。
【答案】2Fe3++2I-2Fe2++I2 隔绝空气中的O2,防止O2氧化Fe2+ 实验2中,采取了增大反应物浓度、升高温度的措施提高化学反应速率,但溶液仍未变红 Fe3+ 加入KSCN后,Fe3+先与SCN-反应生成Fe(SCN)3,溶液变红;Ag+与SCN-反应生成AgSCN,使平衡Fe3++3SCN- Fe(SCN)3逆向移动,红色褪去,产生白色沉淀 0.1mol/LAgNO3溶液 假设ⅰ、ⅱ均不成立 实验1溶液未变红是因为2Fe2++I22Fe3++2I-的限度很小,溶液中Fe3+浓度太低,未能检出
【解析】
I.(1)Fe3+具有强氧化性,I-具有还原性。Fe3+与I-发生氧化还原反应
(2) 实验2中,石蜡密度小不溶于水,加入石蜡油的目的是隔绝空气中的O2。
(3) 反应速率不是导致实验1中溶液未变红的主要原因可以从对比试验来分析。
(4) 试管a的加入1滴KSCN溶液变红色说明含有Fe3+
(5) Fe3++3SCN- Fe(SCN)3 是可逆反应,从平衡移动的角度来分析
(6) 设计实验验证氧化Fe2+的物质
I.(1)Fe3+具有强氧化性,I-具有还原性。Fe3+与I-发生氧化还原反应的离子方程式为2Fe3++2I-2Fe2++I2
(2)实验2中,石蜡密度小不溶于水,加入石蜡油后浮在水面隔绝空气中的O2,防止O2氧化Fe2+。
(3)小组同学做出推断:反应速率不是导致实验1中溶液未变红的主要原因,他们的理由是采取了增大反应物浓度、升高温度的措施提高化学反应速率,但溶液仍未变红。Ag+与SCN-反应生成AgSCN,使平衡Fe3++3SCN- Fe(SCN)3逆向移动,红色褪去,产生白色沉淀 。
(7) II.(4)试管a的加入1滴KSCN溶液变红色说明含有Fe3+
(5). 加入KSCN后,Fe3+先与SCN-反应生成Fe(SCN)3,溶液变红;Ag+与SCN-反应生成AgSCN,使平衡Fe3++3SCN- Fe(SCN)3逆向移动,红色褪去,产生白色沉淀
(6)①需要验证是否是AgNO3氧化了Fe2+,所以试剂a是0.1mol/LAgNO3溶液
②依据实验4,甲同学做出判断②依据实验4,甲同学做出判断
(7)根据实验1~4所得结论是实验1溶液未变红是因为2Fe2++I22Fe3++2I-的限度很小,溶液中Fe3+浓度太低,未能检出。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某同学在室温下进行下图所示实验。(已知:H2C2O4为二元弱酸)
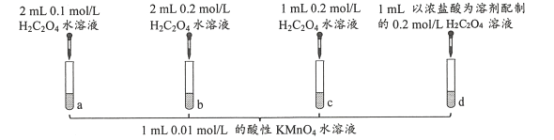
试管a、b、c中溶液褪色分别耗时690s、677s、600s。下列说法正确的是
A.反应的离子方程式为2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
B.试管c反应至300 s时,溶液中剩余的c(KMnO4)=0.0025 mol/L
C.对比试管a、b,得到的结论是H2C2O4水溶液浓度增大,反应速率加快
D.对比试管c、d,可验证H+浓度对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯氏制碱原理:NH3+CO2+H2O+NaCl===NaHCO3↓+NH4Cl,需经过制取氨气、制取NaHCO3、分离及干燥NaHCO3四个步骤,下列图示装置能达到实验目的的是
A. 制取氨气 B. 制取NaHCO3
B. 制取NaHCO3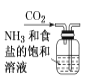
C. 分离NaHCO3 D. 干燥NaHCO3
D. 干燥NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1 mol·L1稀盐酸,CO2的生成量与加入盐酸的体积的关系如图。下列判断正确的是
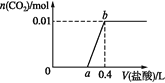
A. 在0~a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:![]()
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈(CH3CN)等,回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
①C3H6(g)+NH3(g)+![]() O2(g)=C3H3N(g)+3H2O(g) ΔH=-515kJ/mol
O2(g)=C3H3N(g)+3H2O(g) ΔH=-515kJ/mol
①C3H6(g)+O2(g)=C3H4O(g)+H2O(g) ΔH=-353kJ/mol
两个反应在热力学上趋势均很大,其原因是________;有利于提高丙烯腈平衡产率的反应条件是________;提高丙烯腈反应选择性的关键因素是________。
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应温度为460℃。低于460℃时,丙烯腈的产率________(填“是”或者“不是”)对应温度下的平衡产率,判断理由是________;高于460℃时,丙烯腈产率降低的可能原因是________(双选,填标号)
A.催化剂活性降低B.平衡常数变大C.副反应增多D.反应活化能增大
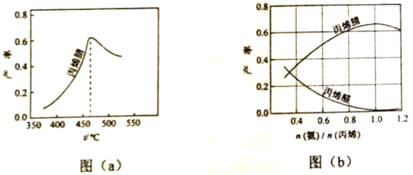
(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示。由图可知,最佳n(氨)/n(丙烯)约为1理由是_______________。进料氨、空气、丙烯的理论体积约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是
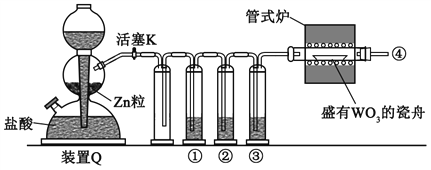
A. ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B. 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C. 结束反应时,先关闭活塞K,再停止加热
D. 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四苯基乙烯(TPE)及其衍生物具有诱导发光特性,在光电材料等领域应用前景广泛。以下是TPE的两条合成路线(部分试剂及反应条件省略):
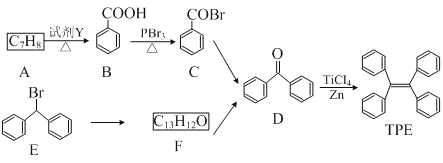
(1)A的名称是__________________;试剂Y为____________________。
(2)B→C的反应类型为_______________;B中官能团的名称是_________________,D中官能团的名称是_______________。
(3)E→F的化学方程式是______________________________________。
(4)W是D的同分异构体,具有下列结构特征:①属于萘(![]() )的一元取代物;②存在羟甲基(-CH2OH)。写出W所有可能的结构简式:______________________。
)的一元取代物;②存在羟甲基(-CH2OH)。写出W所有可能的结构简式:______________________。
(5)下列叙述正确的是______。
a. B的酸性比苯酚强
b. D不能发生还原反应
c. E含有3种不同化学环境的氢
d. TPE既属于芳香烃也属于烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】安全气囊逐渐成为汽车的标配,因为汽车发生剧烈碰撞时,安全气囊中迅速发生反应:10NaN3+2KNO3![]() K2O+5Na2O+16N2↑,产生大量的气体使气囊迅速弹出,保障驾乘车人员安全。下列关于该反应的说法不正确的是
K2O+5Na2O+16N2↑,产生大量的气体使气囊迅速弹出,保障驾乘车人员安全。下列关于该反应的说法不正确的是
A. 该反应中NaN3是还原剂,KNO3是氧化剂
B. 氧化产物与还原产物的物质的量之比为15∶1
C. 若有50.5 g KNO3参加反应,则有1 mol N原子被还原
D. 每转移1 mol e,可生成标准状况下N2的体积为35.84 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com