
【题目】50mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.
试回答下列问题: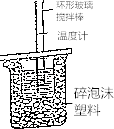
(1)大小烧杯间填满碎纸条的作用是;
(2)大烧杯上如不盖硬纸板,求得的中和热数值将(填“偏大”、“偏小”或“无影响”),结合日常生活的实际该实验在进行效果更好;
(3)实验中改用60mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”、“不相等”),简述理由:;
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会;用50mL 0.5mo1L﹣1NaOH溶液进行上述实验,测得的中和热的数值会(填“偏大”、“偏小”或“无影响”)
【答案】
(1)减少实验过程中的热量损失
(2)偏小;保温杯
(3)不相等;反应放出的热量和所用酸以及碱的量的多少有关
(4)偏小;无影响”
【解析】解:(1)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,所以答案是:减少实验过程中的热量损失;(2)大烧杯上如不盖硬纸板,会使一部分热量散失,求得的中和热数值将会减小;在日常生活实际该实验在保温杯中效果更好;
所以答案是:偏小;保温杯; (3)反应放出的热量和所用酸以及碱的量的多少有关,用60mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,中和热数值相等,
所以答案是:不相等;反应放出的热量和所用酸以及碱的量的多少有关;(4)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量偏小,中和热的数值会偏小;
中和热是强酸和强碱反应生成1mol水时放出的热量,与酸碱的用量无关,所以用5mL 0.50mol/L NaOH溶液进行上述实验,测得的中和热的数值无影响;
所以答案是:偏小;无影响.


科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①、过滤后所得沉淀为氢氧化铁
C. 图中所示转化反应都不是氧化还原反应
D. 反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中蕴含着丰富的资源。利用海水提取淡水、溴和镁的部分过程如图所示。

(1)海水淡化的方法有_________________、离子交换法和电渗析法等。
(2)用纯碱吸收浓缩海水吹出的Br2: 3Br2+ 6Na2CO3+3H2O=5NaBr+ NaBrO3+6NaHCO3。若吸收3 mol Br2时,转移的电子是_________________mol。
(3)海水中部分离子的含量如下:
成分 | 含量( mg/L) | 成分 | 含量( mg/L) |
Na+ | 10560 | Cl- | 18980 |
Mg2+ | 1272 | Br- | 64 |
Ca2+ | 400 | SO42- | 2560 |
其中,Mg2+的物质的量浓度是____________mol/L。若从100 L的海水中提取镁,理论上加入沉淀剂Ca(OH)2的质量是_______________g。
(4)由Mg(OH)2得到单质Mg,以下方法最合适的是________________(填序号)。
A. Mg(OH)2 ![]() MgO
MgO![]() Mg
Mg
B. Mg(OH)2![]() MgO
MgO![]() Mg
Mg
C. Mg(OH)2![]() 无水MgCl2
无水MgCl2![]() Mg
Mg
D. Mg(OH)2 ![]() MgCl2溶液
MgCl2溶液![]() Mg
Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在检验用FeCl3溶液生产铜制印刷线路板后所得的废液成分的实验中,下列根据实验现象得出的结论不正确的是
A. 若用惰性电极电解该废液,阴极没有立即产生红色物质,说明废液中不含Cu2+
B. 若向废液中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明废液中含有C1-
C. 若向废液中加少量铁粉,充分反应后无固体剩余,说明废液中含有Fe3+
D. 若向废液中滴加KSCN 溶液,无现象,再加入氯水后溶液呈血红色,说明废液中含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. Na保存在煤油中;溴保存在棕色试剂瓶,并用水封
B. MgO可作耐高温材料
C. Na2CO3常用来治疗人体胃酸过多
D. K-Na合金可作核反应堆的导热剂;Mg-Al合金可用于制造飞机部件
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80℃时,将0.40mol的N204气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O42NO2 , 隔一段时间对该容器内的物质进行分析,得到如下数据:
时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) | 0.40 | a | 0.20 | c | d | e |
n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20s一40s内用N2O4表示的平均反应速率为molL﹣1S﹣1;
(2)计算在80℃时该反应的平衡常数K=(请注明单位).
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”.“变深”或“不变”)
(4)要增大该反应的K值,可采取的措施有(填序号):
A.增大N2O4的起始浓度
B.向混合气体中通入NO2
C.使用高效催化剂
D.升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线. 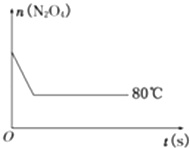
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程中的现象及结论均正确的是

A. 锥形瓶中有气体产生,烧杯中液体变浑浊,证明非金属性:Cl>C>Si
B. 形成美丽的红色喷泉,证明HC1极易溶于水
C. 配制一定物质的量浓度的NaOH溶液时,定容时如图观察使配制的NaOH 溶液浓度偏低
D. 只产生红褐色沉定,证明Ksp[Al(OH3)]>Ksp[Fe(OH)3]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com