
【题目】海洋中蕴含着丰富的资源。利用海水提取淡水、溴和镁的部分过程如图所示。

(1)海水淡化的方法有_________________、离子交换法和电渗析法等。
(2)用纯碱吸收浓缩海水吹出的Br2: 3Br2+ 6Na2CO3+3H2O=5NaBr+ NaBrO3+6NaHCO3。若吸收3 mol Br2时,转移的电子是_________________mol。
(3)海水中部分离子的含量如下:
成分 | 含量( mg/L) | 成分 | 含量( mg/L) |
Na+ | 10560 | Cl- | 18980 |
Mg2+ | 1272 | Br- | 64 |
Ca2+ | 400 | SO42- | 2560 |
其中,Mg2+的物质的量浓度是____________mol/L。若从100 L的海水中提取镁,理论上加入沉淀剂Ca(OH)2的质量是_______________g。
(4)由Mg(OH)2得到单质Mg,以下方法最合适的是________________(填序号)。
A. Mg(OH)2 ![]() MgO
MgO![]() Mg
Mg
B. Mg(OH)2![]() MgO
MgO![]() Mg
Mg
C. Mg(OH)2![]() 无水MgCl2
无水MgCl2![]() Mg
Mg
D. Mg(OH)2 ![]() MgCl2溶液
MgCl2溶液![]() Mg
Mg
【答案】 蒸馏法 5 0.053 392.2 C
【解析】(1)海水淡化的方法主要有蒸馏法、离子交换法、电渗析法等;(2)根据方程式3Br2+6Na2CO3+3H2O=5NaBr+NaBrO3+6NaHCO3可知反应中Br元素化合价分别由0价变化为-1价、+5价,3mol溴单质反应转移电子5mol;(3)根据表中数据可知Mg2+的物质的量浓度是1.272g/L÷24g/mol=0.053mol/L;100 L的海水中Mg2+的含量=0.053mol/L×100L=5.3mol,加入氢氧化钙发生沉淀反应,1molMg2+需要1mol氢氧化钙完全沉淀,因此若从100L的海水中提取镁,理论上加入沉淀剂氢氧化钙的质量=5.3mol×74g/mol=392.2g;(4)制备氢氧化镁的过程为:海水中含有镁离子,首先将镁离子转化为氢氧化镁沉淀,反应方程式为:Mg2++2OH-=Mg(OH)2↓,然后将氢氧化镁溶于盐酸中得到氯化镁溶液,反应方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,用氯化镁溶液在氯化氢氛围中制取无水氯化镁,活泼金属采用电解其熔融盐的方法冶炼,镁是活泼金属,所以最后利用电解熔融氯化镁的方法冶炼镁,反应方程式为:MgCl2![]() Mg+Cl2↑,则A.氧化镁熔点高,要求设备条件高,消耗更多能源,不经济,A错误;B.镁是活泼金属,通常用电解的方法冶炼,不能用碳还原氧化镁制备,B错误;C.根据以上分析可知C正确;D.电解氯化镁溶液,阳极是氯离子失电子生成氯气,阴极是氢离子得到电子生成氢气,同时溶液中生成氢氧化镁沉淀,不能得到金属镁,D错误;答案选C。
Mg+Cl2↑,则A.氧化镁熔点高,要求设备条件高,消耗更多能源,不经济,A错误;B.镁是活泼金属,通常用电解的方法冶炼,不能用碳还原氧化镁制备,B错误;C.根据以上分析可知C正确;D.电解氯化镁溶液,阳极是氯离子失电子生成氯气,阴极是氢离子得到电子生成氢气,同时溶液中生成氢氧化镁沉淀,不能得到金属镁,D错误;答案选C。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】物质的量浓度相同、体积相同的下列溶液中,所含溶质的离子数目最多的是
A.NaCl溶液B.AlCl3溶液
C.Al2(SO4)3溶液D.Na2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,每摩尔CuSO4能氧化P的物质的量为( )
A. 1/5 mol B. 2/5 mol C. 3/5mol D. 11/5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中能对二者进行鉴别的是( ) ①质谱法
②红外光谱法
③核磁共振氢谱
④李比希燃烧法
⑤元素分析仪.
A.①②
B.④⑤
C.②③
D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、体积为2L的密闭容器中进行反应:2A(g) ![]() 3B(g)+C(g),若反应物在前20s由3mol降为1.8mol,则前20s的平均反应速率为( )
3B(g)+C(g),若反应物在前20s由3mol降为1.8mol,则前20s的平均反应速率为( )
A.v(B)=0.03 molL﹣1s﹣1
B.v(C)=0.06 molL﹣1s﹣1
C.v(C)=0.03 molL﹣1s﹣1
D.v(B)=0.045 molL﹣1s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镁晶体(MgSO4·7H2O)是一种重要的化工原料。以菱镁矿(主要成分是MgCO3,含少量FeCO3和不溶性杂质)为原料制取硫酸镁晶体的流程如下:

(1)MgCO3溶于稀硫酸的离子方程式是_________________________。
(2)加入H2O2溶液的目的是____________________(用离子方程式表示)。
(3)已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Mg2+ | Fe2+ | Fe3+ |
开始沉淀 | 9.1 | 7.6 | 1.9 |
完全沉淀 | 11.1 | 9.7 | 3.2 |
“沉淀”步骤中,用氨水调节溶液pH的范围是______________________________。
(4)“过滤”所得滤液中存在大量的阳离子有Mg2+、____________。
(5)“结晶”步骤中需蒸发浓缩滤液,使用的仪器有铁架台、酒精灯和_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.
试回答下列问题: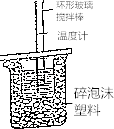
(1)大小烧杯间填满碎纸条的作用是;
(2)大烧杯上如不盖硬纸板,求得的中和热数值将(填“偏大”、“偏小”或“无影响”),结合日常生活的实际该实验在进行效果更好;
(3)实验中改用60mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”、“不相等”),简述理由:;
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会;用50mL 0.5mo1L﹣1NaOH溶液进行上述实验,测得的中和热的数值会(填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g) △H=xkJ·mol-l
已知:①C(s)+O2(g)=CO2(g) △H=akJ·mol-l
②K2S(s)=S(s)+2K(s) △H=bkJ·mol-l
③2K(s)+N2(g)+3O2(g)=2KNO3(s) △H=ckJ·mol-l
下列说法正确的是
A. x>0 a<0
B. b<0 c<0
C. x=3a-b-c
D. 1mol 碳(s)在空气中不完全燃烧生成CO的焓变小于akJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法不正确的是( ) 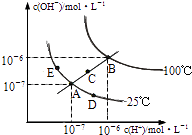
A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到D点,可采用:温度不变在水中加入少量的酸
C.若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体
D.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com