
【题目】在恒温、体积为2L的密闭容器中进行反应:2A(g) ![]() 3B(g)+C(g),若反应物在前20s由3mol降为1.8mol,则前20s的平均反应速率为( )
3B(g)+C(g),若反应物在前20s由3mol降为1.8mol,则前20s的平均反应速率为( )
A.v(B)=0.03 molL﹣1s﹣1
B.v(C)=0.06 molL﹣1s﹣1
C.v(C)=0.03 molL﹣1s﹣1
D.v(B)=0.045 molL﹣1s﹣1
 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:
【题目】U,W,Y是原子序数依次增大的短周期主族元素,在周期表中的相对位置如右表;U元素与氧元素能形成两种无色气体;W是地壳中含量最多的金属元素.
U | |||
W | Y |
(1)元素U的原子核外共有种不同能级的电子.
(2)能提高W与稀硫酸反应速率的方法是
a.使用浓硫酸 b.加热 c.加压 d.使用等质量的W粉末
(3)在恒容密闭容器中进行:2YO2(g)+O2(g) ![]() 2YO3(g)△H2=﹣190kJ/mol
2YO3(g)△H2=﹣190kJ/mol
①该反应 450℃时的平衡常数500℃时的平衡常数(填<,>或=).
②下列描述中能说明上述反应已达平衡的是
a.2ν(O2)正=ν(YO3)逆 b.气体的平均分子量不随时间而变化
c.反应时气体的密度不随时间而变化 d.反应时气体的分子总数不随时间而变化
③在一个固定容积为2L的密闭容器中充入0.20mol YO2和0.10molO2 , 半分钟后达到平衡,测得容器中含YO30.18mol,则ν(O2)=:平衡常数为 . 若继续通入0.20molYO2和0.10molO2 , 再次达到平衡后,YO3物质的量约为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气是城市空气的主要污染物,如何减少汽车尾气(CO,NOx等)的污染是重要的科学研究课题.
(1)已知:N2(g)+O2(g)═2NO(g)△H1
N2(g)+3H2(g)2NH3(g)△H2
2H2(g)+O2(g)═2H2O(g)△H3
则4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=(用含△H1、△H2、△H3的式子表达)
(2)汽车尾气中的CO,NOx都需要除去,有人设想按下列反应除去CO;2CO(g)=2C(s)+O2(g)已知该反应在任何温度下都不能自发进行,因此该设想便不能实现.由此判断该反应的△H0
目前,在汽车尾气系统中装置催化转化器可以减少CO,NO的污染,其化学反应方程式为
(3)可用活性炭还原法处理氮氧化物.有关反应的化学方程式为:C(s)+2NO(g)N2(g)+CO2(g)△H>0某研究小组向密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如表:
浓度/molL﹣1 | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
则,30min后,改变某一条件,平衡发生了移动,则改变的条件是;若升高温度,NO浓度将(填“增大”、“不变”或“减小”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中蕴含着丰富的资源。利用海水提取淡水、溴和镁的部分过程如图所示。

(1)海水淡化的方法有_________________、离子交换法和电渗析法等。
(2)用纯碱吸收浓缩海水吹出的Br2: 3Br2+ 6Na2CO3+3H2O=5NaBr+ NaBrO3+6NaHCO3。若吸收3 mol Br2时,转移的电子是_________________mol。
(3)海水中部分离子的含量如下:
成分 | 含量( mg/L) | 成分 | 含量( mg/L) |
Na+ | 10560 | Cl- | 18980 |
Mg2+ | 1272 | Br- | 64 |
Ca2+ | 400 | SO42- | 2560 |
其中,Mg2+的物质的量浓度是____________mol/L。若从100 L的海水中提取镁,理论上加入沉淀剂Ca(OH)2的质量是_______________g。
(4)由Mg(OH)2得到单质Mg,以下方法最合适的是________________(填序号)。
A. Mg(OH)2 ![]() MgO
MgO![]() Mg
Mg
B. Mg(OH)2![]() MgO
MgO![]() Mg
Mg
C. Mg(OH)2![]() 无水MgCl2
无水MgCl2![]() Mg
Mg
D. Mg(OH)2 ![]() MgCl2溶液
MgCl2溶液![]() Mg
Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在检验用FeCl3溶液生产铜制印刷线路板后所得的废液成分的实验中,下列根据实验现象得出的结论不正确的是
A. 若用惰性电极电解该废液,阴极没有立即产生红色物质,说明废液中不含Cu2+
B. 若向废液中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明废液中含有C1-
C. 若向废液中加少量铁粉,充分反应后无固体剩余,说明废液中含有Fe3+
D. 若向废液中滴加KSCN 溶液,无现象,再加入氯水后溶液呈血红色,说明废液中含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80℃时,将0.40mol的N204气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O42NO2 , 隔一段时间对该容器内的物质进行分析,得到如下数据:
时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) | 0.40 | a | 0.20 | c | d | e |
n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20s一40s内用N2O4表示的平均反应速率为molL﹣1S﹣1;
(2)计算在80℃时该反应的平衡常数K=(请注明单位).
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”.“变深”或“不变”)
(4)要增大该反应的K值,可采取的措施有(填序号):
A.增大N2O4的起始浓度
B.向混合气体中通入NO2
C.使用高效催化剂
D.升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线. 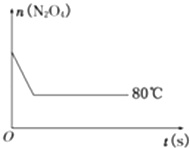
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com