
【题目】钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等领域。
(1)Ti的基态原子的电子排布式为________。
(2)已知TiC在碳化物中硬度最大,工业上一般在真空和高温(>1800℃)条件下用C还原TiO2制取TiC: TiO2+3C![]() TiC+2CO↑。该反应中涉及的元素按电负性由大到小的顺序排列为_____________;根据所给信息,可知TiC是________晶体。
TiC+2CO↑。该反应中涉及的元素按电负性由大到小的顺序排列为_____________;根据所给信息,可知TiC是________晶体。
(3)钛的化合物TiCl4,熔点为-24℃,沸点为136.4℃,常温下是无色液体,可溶于甲苯和氯代烃。
①固态TiCl4属于________晶体,其空间构型为正四面体,则钛原子的杂化方式为__________。
②TiCl4遇水发生剧烈的非氧化还原反应,生成两种酸,反应的化学方程式为_________
③用锌还原TiCl4的盐酸溶液,经后续处理可制得绿色的配合物[TiCl(H2O)5]Cl2·H2O.该配合物中含有化学键的类型有_________、__________。
(4)钛的一种氧化物是优良的颜料,该氧化物的晶胞如右图所示:

该氧化物的化学式为________;在晶胞中Ti原子的配位数为_______,若晶胞边长为a nm,NA为阿伏伽德罗常数的数值,列式表示氧化钛晶体的密度:___________g/cm3。
【答案】 1s22s23s23p63d24s2(或[Ar]3d24s2) O>C>Ti 原子 分子 sp3 TiCl4+3H2O=H2TiO3+4HCl 共价键 离子键 TiO2 6 ![]()
【解析】(1)Ti的质子数是22,基态原子的电子排布式为1s22s23s23p63d24s2(或[Ar]3d24s2)。(2)非金属性越强,电负性越大,则该反应中涉及的元素按电负性由大到小的顺序排列为O>C>Ti;根据所给信息TiC在碳化物中硬度最大,这说明TiC是原子晶体。(3)①钛的化合物TiCl4,熔点为-24℃,沸点为136.4℃,因此固态TiCl4属于分子晶体,其空间构型为正四面体,则钛原子的杂化方式为sp3。②TiCl4遇水发生剧烈的非氧化还原反应,生成两种酸,根据原子守恒应该是盐酸和钛酸,反应的化学方程式为TiCl4+3H2O=H2TiO3+4HCl;③配合物[TiCl(H2O)5]Cl2·H2O中含有化学键的类型有离子键和共价键。(4)氧原子个数=4×1/2+2=4,Ti原子个数=1+8×1/8=2,所以该氧化物的化学式为TiO2;在晶胞中Ti原子的配位数为6。若晶胞边长为a nm,NA为阿伏伽德罗常数的数值,氧化钛晶体的密度=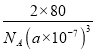 g/cm3。
g/cm3。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】 将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,基本上不影响水的电离平衡的是( )
A.①③⑤⑦⑧ B.②④⑦ C.①⑥ D.②④⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A. 相同条件下,氧化镁的熔点比氧化钙的高
B. 键长的大小与成键原子的半径和成键数目有关
C. 键能越大,键长就越长,共价化合物也就越稳定
D. HF与OH—互为等电子体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示:下列有关该有机物的叙述正确的是( )

A.该有机物的分子式为C11H14O3
B.该有机物可能易溶于水且具有水果香味
C.该有机物可能发生的化学反应类型有:水解、酯化、氧化、取代
D.1mol该有机物在Ni作催化剂的条件下能与4molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香天竺葵醇具有温和、香甜的玫瑰花气息,其结构式如图所示。下列有关香天竺葵醇的说法错误的是

A. 分子中含有两种官能团
B. lmol该物质与lmolHBr发生加成反应的产物共有5种(不考虑立体异构)
C. 使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色的原理不同
D. 香天竺葵醇能发生加聚反应和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物I是以种重要的化工原科,合成路线如下:

已知以下信息:
①![]() ;
;
②![]()
③核磁共振氢谱显示A有2种不同化学环境的氢。
(1)A 的名称是__________。F的结构简式为____________。
(2)A![]() B的反应类型为_______。I中存在的含氧官能团的名称是________。
B的反应类型为_______。I中存在的含氧官能团的名称是________。
(3)写出下列反应的化学方程式。
D![]() E:______________。
E:______________。
E+H![]() I:_____________。
I:_____________。
(4)I的同系物J比I相对分子质量小28,J的同分异构体中能同时润足如下条件的共有_____种(不考虑立体异构)。
① 苯环上只有两个取代基;②既能发生银镜反应,又能和饱和NaHCO3溶液反应放出CO2。
(5)参照上述合成路线,以![]() 为原料(无机试剂任选),设计制备苯乙酸(
为原料(无机试剂任选),设计制备苯乙酸(![]() )的合成路线:____________。
)的合成路线:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化学(选修模块)乙酸苯甲酯是制造香精的原料之一,其合成路线如下:

(1)乙酸苯甲酯的分子式为____________,反应Ⅰ的反应类型为____________。
(2)A的结构简式为_____________,B中含有的官能团的名称为______________。
(3)反应Ⅲ的化学方程式为_________________________________。
(4)![]() 不能发生的化学反应是___________(填序号)。
不能发生的化学反应是___________(填序号)。
a.取代反应 b.消去反应 c.加成反应
(5)C属于芳香族化合物的同分异构体的结构简式为___________(写出一种即可)。
(6)反应Ⅳ的化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应方程式为:[Cu(NH3)2]OOCCH3+CO+NH3=[Cu(NH3)3(CO)]OOCCH3。
请回答下列问题:
(1)C、N、O的电负性由大到小的顺序为_________________,基态Fe原子的价电子排布图为________________。
(2)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是__________,与CO互为等电子体的分子的电子式为_________________。
(3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是_____________,配体中提供孤对电子的原子是___________________________________。
(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有_______________形成。
a.离子键 b.配位键 c.非极性键 d.б键
(5)NaAlH4晶体的晶胞如图 ,与Na+紧邻且等距的AlH4-有___________个;NaAlH4晶体的密度为_________g·cm-3(用含a的代数式表示)。
,与Na+紧邻且等距的AlH4-有___________个;NaAlH4晶体的密度为_________g·cm-3(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素的单质和化合物在生产生活中有重要的用途。
(1)溴原子的核外电子排布式为[Ar]__________,有_____个未成对电子。
(2)在一定浓度的 HF 溶液中,氟化氢是以缔合形式(HF)2 存在的。使氟化氢分子缔合的作用力是____________。
(3)根据下表数据,分析熔点和硬度变化的原因:________________。
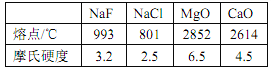
(4)HIO3 的酸性_____(填“强于”或“弱于”)HIO4,原因是_________________。
(5)ClO2中心氯原子的杂化类型为________,ClO3的空间构型为__________。
(6)晶胞有两个基本要素:
①原子坐标参数:表示晶胞内部各微粒的相对位置。下图是 CaF2 的晶胞,其中原子坐标参数 A 处为(0,0,0);B 处为(![]() ,
, ![]() ,0);C 处为(1,1,1)。则 D 处微粒的坐标参数为__________。
,0);C 处为(1,1,1)。则 D 处微粒的坐标参数为__________。

②晶胞参数:描述晶胞的大小和形状。已知 CaF2 晶体的密度为 c gcm3,则晶胞中 Ca2+与离它最近的 F之间的距离为_________ nm(设 NA 为阿伏加德罗常数的值,用含 c、NA 的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com