
����Ŀ��±��Ԫ�صĵ��ʺͻ���������������������Ҫ����;��
��1����ԭ�ӵĺ�������Ų�ʽΪ[Ar]__________����_____��δ�ɶԵ��ӡ�
��2����һ��Ũ�ȵ� HF ��Һ�У����������Ե���ʽ(HF)2 ���ڵġ�ʹ��������ӵϵ���������____________��
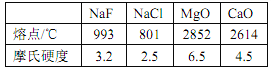
��3�������±����ݣ������۵��Ӳ�ȱ仯��ԭ��________________��
��4��HIO3 ������_____���ǿ�ڡ������ڡ���HIO4��ԭ����_________________��
��5��ClO2������ԭ�ӵ��ӻ�����Ϊ________��ClO3�Ŀռ乹��Ϊ__________��
��6����������������Ҫ�أ�
��ԭ�������������ʾ�����ڲ����������λ�á���ͼ�� CaF2 �ľ���������ԭ��������� A ��Ϊ(0��0��0)��B ��Ϊ(![]() ��
�� ![]() ��0)��C ��Ϊ(1��1��1)���� D �������������Ϊ__________��
��0)��C ��Ϊ(1��1��1)���� D �������������Ϊ__________��

�ھ������������������Ĵ�С����״����֪ CaF2 ������ܶ�Ϊ c gcm3������ Ca2+����������� F֮��ľ���Ϊ_________ nm���� NA Ϊ�����ӵ�������ֵ���ú� c��NA ��ʽ�ӱ�ʾ����
���𰸡� 3d104s24p5 1 ��� ���Ӿ��������Ӱ뾶ԽС�����������ĵ��Խ�࣬�����ܾ�Խ������۵�Խ�ߣ�Ħ��Ӳ��Խ�� ���� HIO4�����е�ļ�̬��HIO3�и��ߣ�����I-O-H��O�ĵ�����Iƫ�Ƶø��࣬��ˮ���ӵ������£����������H+�������Ը�ǿ sp3 ������ ��![]() ��
�� ![]() ��
�� ![]() ��
�� ![]()
��������(1)��Ϊ35��Ԫ�أ���ԭ�ӵĺ�������Ų�ʽΪ[Ar] 3d104s24p5��4p5����1��δ�ɶԵ��ӣ��ʴ�Ϊ��3d104s24p5 ��1��
(2)��������Ӽ������γ��������һ��Ũ�ȵ� HF ��Һ�У����������Ե���ʽ(HF)2 ���ڵġ�ʹ��������ӵϵ���������������ʴ�Ϊ�������
(3)���Ӿ��������Ӱ뾶ԽС�����������ĵ��Խ�࣬�����ܾ�Խ������۵�Խ�ߣ�Ħ��Ӳ��Խ�����־����У������Ӱ뾶�������Ӱ뾶С�������Ƶ��۵��Ӳ�ȱ��Ȼ��Ƹߣ�þ���Ӱ뾶�ȸ����Ӱ뾶С������þ���۵��Ӳ�ȱ������Ƹߣ�����þ�������������Ӵ�2����λ��ɣ��������ƺ��Ȼ��������Ӵ�1����λ��ɣ��������þ�������Ƶ��۵��Ӳ�ȱȷ����ƺ��Ȼ��Ƹߣ��ʴ�Ϊ�����Ӿ��������Ӱ뾶ԽС�����������ĵ��Խ�࣬�����ܾ�Խ������۵�Խ�ߣ�Ħ��Ӳ��Խ��
(4)HIO4�����е�ļ�̬��HIO3�и��ߣ�����I-O-H��O�ĵ�����Iƫ�Ƶø��࣬��ˮ���ӵ������£����������H+�������Ը�ǿ���ʴ�Ϊ�����ڣ�HIO4�����е�ļ�̬��HIO3�и��ߣ�����I-O-H��O�ĵ�����Iƫ�Ƶø��࣬��ˮ���ӵ������£����������H+�������Ը�ǿ��
(5)ClO2������ԭ�ӵļ۲���Ӷ���=2+![]() ��(7+1-2��2)=4������sp3�ӻ���ClO3������ԭ�ӵļ۲���Ӷ���=3+
��(7+1-2��2)=4������sp3�ӻ���ClO3������ԭ�ӵļ۲���Ӷ���=3+![]() ��(7+1-2��3)=4������sp3�ӻ����ռ乹��Ϊ�����Σ��ʴ�Ϊ��sp3 �� �����Σ�
��(7+1-2��3)=4������sp3�ӻ����ռ乹��Ϊ�����Σ��ʴ�Ϊ��sp3 �� �����Σ�
(6)������ԭ��������� A ��Ϊ(0��0��0)��˵��AΪ����ԭ�㣬B ��Ϊ(![]() ��
�� ![]() ��0)����D��C ��Ϊ(1��1��1)����D�������������Ϊ(
��0)����D��C ��Ϊ(1��1��1)����D�������������Ϊ(![]() ��
�� ![]() ��
�� ![]() ) ���ʴ�Ϊ��(
) ���ʴ�Ϊ��(![]() ��
�� ![]() ��
�� ![]() )��
)��
��CaF2�����У��������ĿΪ8��![]() +6��
+6��![]() =4������ȫ���ھ����ڲ�����ĿΪ8����ͼ�а����Ǹ����ӣ��Ѿ����ֳ�8��С����������ͼ
=4������ȫ���ھ����ڲ�����ĿΪ8����ͼ�а����Ǹ����ӣ��Ѿ����ֳ�8��С����������ͼ ����F-λ��С����������ģ���С������Ca2+��F-֮����������ΪС���������Խ��ߵ�һ�롣CaF2 ������ܶ�Ϊ c gcm3��1mol����������Ϊ4��78g�����ı߳�Ϊ
����F-λ��С����������ģ���С������Ca2+��F-֮����������ΪС���������Խ��ߵ�һ�롣CaF2 ������ܶ�Ϊ c gcm3��1mol����������Ϊ4��78g�����ı߳�Ϊ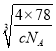 cm=
cm=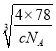 ��107 nm�����Ca2+��F-֮����������Ϊ
��107 nm�����Ca2+��F-֮����������Ϊ![]() ��
�� ��107 nm
��107 nm
�ʴ�Ϊ�� ![]() ��
��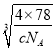 ��107��
��107��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ѽ��仯���ﱻ�㷺Ӧ���ڷɻ�����������ǡ���ͧ��ҽ���Լ�ʯ�ͻ���������
��1��Ti�Ļ�̬ԭ�ӵĵ����Ų�ʽΪ________��
��2����֪TiC��̼������Ӳ�����ҵ��һ������պ��£�>1800�棩��������C��ԭTiO2��ȡTiC�� TiO2+3C![]() TiC+2CO�����÷�Ӧ���漰��Ԫ�ذ��縺���ɴ�С��˳������Ϊ_____________������������Ϣ����֪TiC��________���塣
TiC+2CO�����÷�Ӧ���漰��Ԫ�ذ��縺���ɴ�С��˳������Ϊ_____________������������Ϣ����֪TiC��________���塣
��3���ѵĻ�����TiCl4���۵�Ϊ-24�棬�е�Ϊ136.4�棬����������ɫҺ�壬�����ڼױ����ȴ�����
�ٹ�̬TiCl4����________���壬��ռ乹��Ϊ�������壬����ԭ�ӵ��ӻ���ʽΪ__________��
��TiCl4��ˮ�������ҵķ�������ԭ��Ӧ�����������ᣬ��Ӧ�Ļ�ѧ����ʽΪ_________
����п��ԭTiCl4��������Һ���������������Ƶ���ɫ�������[TiCl(H2O)5]Cl2��H2O.��������к��л�ѧ����������_________��__________��
��4���ѵ�һ�������������������ϣ���������ľ�������ͼ��ʾ��

��������Ļ�ѧʽΪ________���ھ�����Tiԭ�ӵ���λ��Ϊ_______���������߳�Ϊa nm,NAΪ����٤����������ֵ����ʽ��ʾ�����Ѿ�����ܶȣ�___________g/cm3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ӧ���������ˮ���ص��ǣ� ��
A. ������ˮB. NaCl�������������͵�ζ��
C. �ȵĴ�����Һ��ȥ������D. FeCl3������Һ�����ˮ���Ʊ�Fe(OH)3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ���У���̬ԭ����δ�ɶԵ���������������������ͬ��Ԫ���м���
A. 2 B. 3 C. 4 D. 5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������£����ڿ��淴ӦX (g) +4Y (g) ![]() 2Z (g)����X��Y��Z����ʼŨ�ȷֱ�Ϊc1��c2��c3 (����Ϊ��)���ﵽƽ��ʱ��X��Y��Z��Ũ�ȷքeΪ0.lmol/L��0.4mol/L�� 0.1mol/L���������ж���ȷ����( )
2Z (g)����X��Y��Z����ʼŨ�ȷֱ�Ϊc1��c2��c3 (����Ϊ��)���ﵽƽ��ʱ��X��Y��Z��Ũ�ȷքeΪ0.lmol/L��0.4mol/L�� 0.1mol/L���������ж���ȷ����( )
A. c1��c2=4��1 B. ƽ��ʱ��Y��Z����������֮��Ϊ1: 2
C. c1��ȡֵ��ΧΪ0mol/L<c1<0.14mol/L D. X��Y��ת�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з����У���ԭ�Ӿ�����ͬһƽ���ϵ��ǣ� ��
A. NH3B. CHCl3C. H2OD. SiH4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯ�ͻ�����һ�ֲ�ƷA����ϩ��Ϊ��Ҫԭ�Ϻϳ�һ�־��й���ζ������E�������������£�
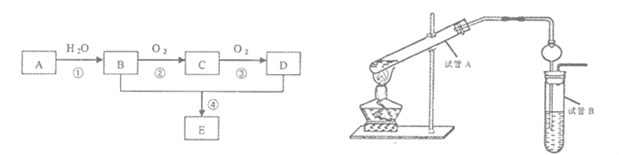
��1��д������ٵĻ�ѧ����ʽ_______________��Ӧ����__________��
����ڵĻ�ѧ����ʽ______________��Ӧ����__________��
��2��ijͬѧ������ͼװ���Ʊ�����E���ش��������⣺
���Թ�A������Ӧ�Ļ�ѧ����ʽ_______________________��
���Թ�B�е��Լ���______________________�����������������ʵ�������______________����������ƣ����õ�����Ҫ��������Ϊ____________________��
�۲����ұ��Թܵĵ��ܽ���һ����״�������Ϊ_______________________��
��3��Ϊ���Ʊ���Ҫ���л�ԭ�ϡ���������(CH3��CH2Cl)����������λͬѧ��Ƶķ�����
��ͬѧ��ѡ��������������ڹ����������Ʊ���ԭ���ǣ�
CH3��CH3+Cl2 ![]() CH3��CH2Cl+HCl
CH3��CH2Cl+HCl
��ͬѧ��ѡ��ϩ�������Ȼ�����һ���������Ʊ���ԭ���ǣ�
CH2=CH2+HCl��CH3��CH2Cl
����Ϊ������λͬѧ�ķ����У���������____������������ɣ�____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��AlCl3��һ�ִ�����ijУѧϰС��������װ���Ʊ�����AlCl3����֪��AlCl3���������е�ˮ����ʱ�ܾ��ҷ�Ӧ����Al(OH)3��HCl��AlCl3��180��ʱ����������Ҫ������������⣺

��1��a����������Ϊ_______��Aװ���з�Ӧ�Ļ�ѧ����ʽΪ_______��
��2���Լ�bΪ_______��Cװ�õ�����Ϊ_______��
��3������d���ܽϴֵ�ԭ����_______��Eװ�õ�����Ϊ_______��
��4��Fװ�õ�����Ϊ_______��
��5������ͼ�е�D��Eװ�ø�Ϊ����װ�ã�Dװ���е�����Ϊ_______�������ӷ���ʽ��ʾE�е�����仯_______��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��A��B��D��E��G��J�����ڱ��е�λ�����£�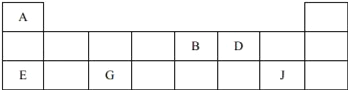
��1�������ϱ��ش����⣺
��D�����ڱ��е�λ����__��
��A��B��E��G��ԭ�Ӱ뾶�ɴ�С��˳����__����Ԫ�ط��ţ���
��B��D����̬�⻯����ȶ��Թ�ϵΪ__���ѧʽ����
��34Se��Dͬ���壬��ǽ����Ա�D__������ǿ����������������ԭ�ӽṹ�ĽǶȽ�����ԭ��Ϊ__��
��E��G��J������������Ӧˮ��������֮�䷴Ӧ�����ӷ���ʽ�ֱ�Ϊ����H++OH��=H2O������_________������________��
��2����ͼ��ʾת����ϵ�еĸ���������������Ԫ�ص�һ�ֻ������ɣ����мס��ҡ�������Ϊ����Ԫ����ɵĻ�����ס����ķ�������10����������Ϊ�����ܼ�����ͼ�в��ֲ������ԣ�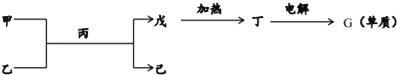
�����ʼ��к��еĻ�ѧ��������Ϊ__��
���õ���ʽ��ʾ�����ӵ��γɹ���Ϊ__��
���ɶ�����Ƶ�G���ʵĻ�ѧ��Ӧ����ʽΪ__��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com