
【题目】A、B、C均为中学化学常见的单质, 其中一种是常见金属,通常状况下,A为固体,B为深红棕色液体,C为气体,其余均为化合物,X是一种具有挥发性的无氧强酸,E为黑色晶体,H为无色液体,它们之间的转化关系如图(其中某些反应条件和产物已略去)。

(1)在反应①~⑦中,不属于氧化还原反应的是______ (填序号)。
(2)G溶液与氯气按物质的量1∶1反应的离子方程式:________ 。
(3)反应⑦的化学方程式为 _______。
【答案】③⑥2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-3Fe+4H2O![]() Fe3O4+4H2
Fe3O4+4H2
【解析】
根据转化关系的特征和物质性质分析判断,单质A和H反应生成E为黑色晶体,E黑色固体和X酸反应生成D、G、H,其中D、G之间可以实现相互转化,说明A为变价金属Fe,铁和C在点燃条件下生成黑色固体E为Fe3O4,C为O2,根据D+A=G说明D为含三价铁离子的化合物,F为含硫氰酸根离子的化合物,G为含Fe2+离子的化合物,H为H2O;根据G+B=D分析判断B是强氧化剂,常温下为液体的氧化剂单质判断为:Br2,所以推断D为FeBr3,得到G为FeBr2,X为HBr,据以上分析解答。
(1) 通过以上分析知:③⑥的反应中各元素的化合价不变,所以不属于氧化还原反应,故选③⑥;正确答案:③⑥。
(2)G溶液为FeBr2,还原性:Fe2+>Br-,1mol Fe2+完全被氧化转移电子1mol,1mol Br-全完被氧化转移电子1mol;因此Fe2+、Br-、Cl2按1:1:1发生氧化还原反应,反应的离子方程式为:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-;正确答案:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-。
(3)铁与水蒸气高温下反应生成四氧化三铁和氢气,化学方程式为:3Fe+4H2O![]() Fe3O4+4H2;正确答案:3Fe+4H2O
Fe3O4+4H2;正确答案:3Fe+4H2O![]() Fe3O4+4H2。
Fe3O4+4H2。


科目:高中化学 来源: 题型:
【题目】钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:
![]()
已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:__________。
(2)用盐酸酸浸时发生反应的离子方程式为: __________。
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有_____________________。
②如何证明晶体已洗净?_______________________。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:_______________。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:________。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.1mol/L,则c(CO32-)在浸出液中的最大浓度为__________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下的固定容器中发生反应2SO2(g)+O2(g)![]() 2SO3(g),其浓度与时间的关系如下表。下列说法错误的是( )
2SO3(g),其浓度与时间的关系如下表。下列说法错误的是( )

A. 0 min时正反应速率最大,逆反应速率为零
B. 0~40 min内,正反应速率大于逆反应速率
C. 50 min时达到了化学平衡,此时正反应速率等于逆反应速率
D. 50 min及以后的时间内,都处于平衡状态,反应物和生成物的浓度不再发生变化,反应停止了
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴(Co)及其化合物在工业上有广泛应用。利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO等)制取CoC12·6H2O粗品的工艺流程图如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、A13+等;
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的pH如下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
请回答下列问题:
(1)上述工艺流程图中操作a的名称:_______________。
(2)写出“浸出”时Co2O3发生反应的离子方程式:____________________。
(3)加入NaC1O3的作用是________________ 。
(4)萃取剂对金属离子的萃取率与pH的关系如图。使用萃取剂最适宜的pH范围是_________(填字母序号)。
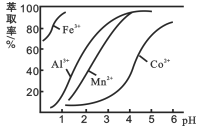
A.2.0~2.5 B. 3.0~3.5 C. 5.0~5.5 D. 9.5~9.8
(5)“除钙”“镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知某温度下,Ksp(MgF2)=7.35×10-11, Ksp(CaF2)=1.50×10-10。当加入过量NaF,所得滤液中c(Mg2+)/c(Ca2+)=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列溶液中水的电离程度最小的是
A. pH=11的氨水 B. 0.01 mol/L的Na2CO3溶液
C. 0.01 mol/L的盐酸 D. pH=4的NaHSO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各种仪器:①漏斗②容量瓶③表面皿④分液漏斗⑤天平⑥量筒⑦胶头滴管⑧蒸馏烧瓶。常用于物质分离的是( )
A.①③⑦B.②⑥⑦
C.①④⑧D.④⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关电解质溶液的说法正确的是( )
A. 将Na2CO3溶液用水稀释后,pH变大,Kw不变
B. 向有AgCl固体的饱和溶液中加少许水,c(Ag+)和Ksp(AgCl)都不变
C. pH=4.75浓度均为0.1mol/L的CH3COOH、CH3COONa的混合溶液中:c(CH3COO-)+c(OH-)<c(H+)+c(CH3COOH)
D. 分别用pH=2和pH=3 的 CH3COOH溶液中和等物质的量的NaOH,消耗CH3COOH溶液的体积分别为Va和Vb,则10Va=Vb
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com