
【题目】对下列实验现象及其解释不正确的是
A. 金属钠在Cl2中燃烧产生白烟,这是因为产生的NaCl固体颗粒分散到空气中所致
B. 把烧红的铁丝放在氧气中,发出耀眼白光,产生黑色固体,这是因为该反应放热多,生成的Fe3O4为黑色
C. 单质Mg、Al与O2反应,条件不同,可能产生不同的产物
D. 镁带在空气中点燃发出耀眼光芒,并发生三个反应:2Mg+O2![]() 2MgO、3Mg+N2
2MgO、3Mg+N2![]() Mg3N2、2Mg+CO2
Mg3N2、2Mg+CO2![]() 2MgO+C(黑色),Mg常用于照明弹。在这些反应中,Mg都是作还原剂
2MgO+C(黑色),Mg常用于照明弹。在这些反应中,Mg都是作还原剂
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】日常生活中常用到化学知识,下列说法不正确的是( )
A. 白色污染、绿色食品中的“白”、“绿”均指相关物质的颜色
B. 用食醋可以除去热水壶中的水垢
C. 聚氯乙烯塑料有毒,不可用于制食品包装袋
D. 新制的Cu(OH)2可以检测糖尿病患者尿液中是否含有葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硝酸厂尾气中较高浓度NOx气体(含NO、NO2)制备NaNO2、NaNO3,流程如下:
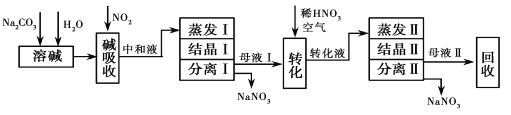
已知:NaOH+NO+NO2═2NaNO2+H2O
(1)写出Na2CO3溶液和NO、NO2反应的化学方程式_______________________________。
(2)中和液所含溶质除NaNO2及少量Na2CO3 外,还有少量___________和___________(填化学式)。
(3)中和液进行蒸发Ⅰ操作时,应控制水的蒸发量,避免浓度过大,目的是____________________;蒸发Ⅰ产生的蒸气中含有少量的NaNO2等有毒物质,不能直接排放,将其冷凝后用于流程中的______________(填操作名称)最合理。
(4)母液Ⅱ需 回收利用,下列处理方法合理的是________________________。
a.转入中和液 b.转入结晶Ⅰ操作 c.转入转化液 d.转入结晶Ⅱ操作
(5)NaNO2能与N2H4反应生成NaN3,该反应中NaNO2_____(填“被氧化”或“被还原”)
N2H4 的电子式是____________________,NaN3 中含有的化学键类型是______________________。
(6)若将NaNO2、NaNO3两种产品的物质的量之比设为2∶1,则生产1.38吨NaNO2时,Na2CO3的理论用量为________________吨(假定Na2CO3恰好完全反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于乙烯和乙烷的说法中错误的是
A.乙烯是不饱和烃,乙烷是饱和烃
B.乙烯能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色,乙烷则不能
C.乙烯分子中碳碳双键的键能是乙烷分子中碳碳单键键能的两倍,因此乙烯比乙烷稳定
D.乙烯分子为平面结构,乙烷分子为立体结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯类化合物H是一种医药中间体,常用于防晒霜中紫外线的吸收剂。实验室由化合物A和E制备H的一种合成路线如下图:

已知
①![]()
②![]()
回答下列问题:
(1)经测定E的相对分子质量为28,常用来测定有机物相对分子质量的仪器为___________。
F中只有一种化学环境的氢原子,其结构简式为_________________。
G中只有一种官能团,F→G的反应类型为___________________。
(2)(CH3)2SO4是一种酯,其名称为_________________。
(3)A能与Na2CO3溶液及浓溴水反应,且1molA最多可与2molBr2反应。核磁共振氢谱表明A的苯环上有四种不同化学环境的氢原子。A的结构简式为________________。C中含氧官能团的结构简式为_________。
(4)D+G→H的化学方程式为__________________。
(5)C的同分异构体中能同时满足下列条件的共有_____种(不含立体异构)。
①遇FeCl3溶液发生显色反应 ②能发生水解反应
(6)参照上述合成路线,设计一条由![]() 和(CH3)3CCl为起始原料制备
和(CH3)3CCl为起始原料制备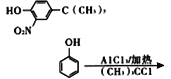 的合成路线(其他试剂任选);____________________
的合成路线(其他试剂任选);____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,浓度为0.1 mo1·L-1的6种溶液:①HCl,②CH3COOH ③Ba(OH)2 ④Na2CO3 ⑤KCl ⑥NH4Cl溶液pH由小到大的顺序为_______________(填写编号)
(2)25℃时,醋酸的电离常数Ka=1.7×10-5mol/L,则该温度下CH3COONa的水解平衡常数Kh=_______ mo1·L-1 (保留到小数点后一位)。
(3)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈________(填“酸性”,“中性”或“碱性”),请写出溶液中离子浓度间的一个等式:________________________________。
(4)25℃时,将mmol/L的醋酸和nmol/L的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中c(CH3COO-)+c(CH3COOH)= _____________,m与n的大小关系是m_____n(填“>”“=”或“<”)。
(5)当300mL1 mo1·L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沉淀的生成、溶解和转化在无机物制备和提纯以及科研等领域有广泛应用。
Ⅰ.汽车尾气中的SO2可用石灰水来吸收,生成CaSO3浊液。已知常温下Ka1(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9 常温下测得某纯CaSO3与水形成的浊液pH=9,忽略SO32-的第二步水解,则Ksp(CaSO3)=__________ 。CaSO3易变质为CaSO4,水垢中含有较多的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。CaSO4转化为CaCO3的离子方程式为:_________;
Ⅱ.已知25℃时,NH3H2O电离常数Kb=1.8×10-5,Ksp[Mg(OH)2]=1.0×10-11,向0.4mol/L的氨水中加入等体积浓度为6×10-4mol/L MgCl2 溶液,________沉淀生成(填“无”或“有”),并简述理由______;若某溶液中C(Mg2+)=1.2×10-3mol/L,需向其中加入等体积的NaOH溶液浓度为_____ mol/L时,可使Mg2+恰好沉淀完全(忽略溶液体积变化)。
Ⅲ.工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3
Cr(OH)3
其中第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
①若平衡体系的pH=2,则溶液显____________色。
②能说明第①步反应达平衡状态的是_____________。
A.Cr2O72-和CrO42-的浓度相同 B.2v (Cr2O72-) =v (CrO42-) C.溶液的颜色不变
③第②步中,还原1mol Cr2O72-离子,需要________mol的FeSO4·7H2O。
④第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+ (aq)+3OH-(aq) 常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至__________。
Cr3+ (aq)+3OH-(aq) 常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com