
����Ŀ����1��25��ʱ��Ũ��Ϊ0.1 mo1��L-1��6����Һ����HCl����CH3COOH ��Ba(OH)2 ��Na2CO3 ��KCl ��NH4Cl��ҺpH��С�����˳��Ϊ_______________����д��ţ�
��2��25��ʱ������ĵ��볣��Ka=1.7��10-5mol/L������¶���CH3COONa��ˮ��ƽ�ⳣ��Kh=_______ mo1��L-1 ��������С�����һλ����
��3��25��ʱ��pH=3�Ĵ����pH=11������������Һ�������Ϻ���Һ��________(������������������������������)����д����Һ������Ũ�ȼ��һ����ʽ��________________________________��
��4��25��ʱ����mmol/L�Ĵ����nmol/L������������Һ�������Ϻ���Һ��pH=7������Һ��c(CH3COO-)+c(CH3COOH)= _____________��m��n�Ĵ�С��ϵ��m_____n(����>����=������<��)��
��5����300mL1 mo1��L-1��NaOH��Һ���ձ�״����4.48LCO2ʱ��������Һ�и�����Ũ���ɴ�С��˳��Ϊ_________________________________________��
���𰸡� ��<��<��<��<��<�� 5.9��10-10 ���� (H+)+(Na+)=(CH3COO-)+C(OH-) ![]() mol/L > c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
mol/L > c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
��������������Ҫ��������ˮ�⡣
��1��25��ʱ��Ũ��Ϊ0.1 mo1��L-1��6����Һ����HCl��ȫ�������H+����CH3COOHС���ֵ������H+����Ba(OH)2��ȫ�������OH-����Na2CO3ˮ�����OH-����ˮ��̶�С����KCl��Һ�����ԣ�pH=7����NH4Clˮ�����H+����ˮ��̶�С�ڢ�CH3COOH�ĵ���̶ȣ�������ҺpH��С�����˳��Ϊ��<��<��<��<��<����
��2��25��ʱ������ĵ��볣��Ka=1.7��10-5mol/L������¶���CH3COONa��ˮ��ƽ�ⳣ��Kh= =
=![]() 5.9��10-10mo1��L-1��
5.9��10-10mo1��L-1��
��3��25��ʱ��pH=3�Ĵ����pH=11������������Һ�������Ϻ�ʣ��������ᣬ��Һ�����ԣ���Һ�е���غ���(H+)+(Na+)=(CH3COO-)+C(OH-)��
��4��c(CH3COO-)+c(CH3COOH)= ![]() mol/L������������������ǡ����ȫ��Ӧ�γɴ�������Һ���������ˮ��ʹ��Һ�ʼ��ԣ�����Һ��pH=7ʱ��ʣ����ᣬm>n��
mol/L������������������ǡ����ȫ��Ӧ�γɴ�������Һ���������ˮ��ʹ��Һ�ʼ��ԣ�����Һ��pH=7ʱ��ʣ����ᣬm>n��
��5����300mL1mo1��L-1��NaOH��Һ(����0.3molNaOH)���ձ�״����4.48L��0.2molCO2ʱ��3OH��+2CO2![]()
![]() +
+![]() +H2O���γɵ�Ũ�ȵ�NaHCO3��Na2CO3�Ļ����Һ��
+H2O���γɵ�Ũ�ȵ�NaHCO3��Na2CO3�Ļ����Һ�� ![]() ��
��![]() ˮ��ʹ��Һ�ʼ��ԣ����ǵ�ˮ��̶Ⱥ�С����ˮ��̶ȣ�
ˮ��ʹ��Һ�ʼ��ԣ����ǵ�ˮ��̶Ⱥ�С����ˮ��̶ȣ� ![]() <
<![]() ����ˣ�������Һ�и�����Ũ���ɴ�С��˳��Ϊc(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)��
����ˣ�������Һ�и�����Ũ���ɴ�С��˳��Ϊc(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.1000mol��L-1HCl��Һ�ζ�10.00mLŨ��Ϊ0.1000 mol��L-1Na2CO3��Һ�����õζ�������ͼ��ʾ����֪H2CO3��Ka1=10-6.4��Ka2=10-10.2������˵������ȷ����

A. m=11.6
B. ��V=5ʱ��c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
C. ���÷�̪��ָʾ������Һ�ɺ�ɫ��Ϊdz��ɫʱ�������������ԼΪ10mL
D. ��V=aʱc(Na+)>c(Cl-)>c(H+)=c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ�����SO2�����Ƿ�ﵽ�ŷű��ķ�Ӧԭ����SO2 +H2O2 + BaCl2 ===BaSO4��+ 2HCl��NA��ʾ����٤������������˵����ȷ���ǣ� ��
A. 0.1 mol BaCl2����������������Ϊ0.1NA
B. 25 ��ʱ��pH =1��HCl��Һ�к���H+����ĿΪ0.1NA
C. 17 g H2O2�к��зǼ��Լ���ĿΪ0.5NA
D. ����2.33 g BaSO4����ʱ��ת�Ƶ�����ĿΪ0.01NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ����������Ͳ���ȷ����
A. ��������Cl2��ȼ�ղ������̣�������Ϊ������NaCl���������ɢ������������
B. ���պ����˿���������У�����ҫ�۰⣬������ɫ���壬������Ϊ�÷�Ӧ���ȶ࣬���ɵ�Fe3O4Ϊ��ɫ
C. ����Mg��Al��O2��Ӧ��������ͬ�����ܲ�����ͬ�IJ���
D. þ���ڿ����е�ȼ����ҫ�۹�â��������������Ӧ��2Mg��O2![]() 2MgO��3Mg��N2
2MgO��3Mg��N2![]() Mg3N2��2Mg��CO2
Mg3N2��2Mg��CO2![]() 2MgO��C(��ɫ)��Mg������������������Щ��Ӧ�У�Mg��������ԭ��
2MgO��C(��ɫ)��Mg������������������Щ��Ӧ�У�Mg��������ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̼��⼼��������ԭ���ԭ������������ˮ��һ�ֹ��գ�װ����ͼ�����϶˿��ڹرգ��ɵõ�ǿ��ԭ�Ե�H+����ԭ�ӣ������϶˿��ڴ�������������ɵõ�ǿ�����Եġ�OH���������ɻ���������˵���������

A. �����Ƿ��������������ĵ缫��Ӧʽ��ΪFe-2e-=Fe2+
B. ���������ʱ�������ĵ缫��ӦʽΪH++e-=H��
C. �������ʱ��ÿ����1mol��OH��2mol���ӷ���ת��
D. �������в��ᣨH2C2O4������ˮʱ���϶˿���Ӧ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж��ڡ�Ħ���������ⲻ��ȷ���ǣ� ��
A.Ħ����һ��������
B.Ħ�������ʵ����ĵ�λ�����Ħ������Ϊmol
C.1mol12C��0.012kg12C����̼ԭ������ͬ
D.1molO2Լ��6.02��1023��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��������ʻ���;��˵������ȷ����
A.������Ũ�����������������
B.ClO2���������ԣ�����������ˮ��ɱ������
C.ȼ�ŵ�þ������ʢ��������̼�ļ���ƿ�пɼ���ȼ��
D.����ͭ������ǿ�����Կ���FeCl3��ʴCu����ӡˢ��·��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����������(����������������)��ȡ���Ĺ������£�
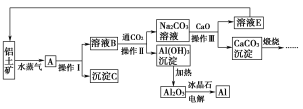
��ش��������⣺
(1)��˵������C�ڹ�ҵ�ϵ�һ����;��_____________________��
(2)���������У���NaOH��H2O����ѭ��ʹ���⣬������ѭ��ʹ�õ�������_____(�ѧʽ)��
(3)����������Ͳ�������________(���������)��ʵ����ϴ��Al(OH)3�����ķ�����__________________________________________��
(4)������ڵ������������õ���״����22.4 L O2����ͬʱ������������Ϊ________g��
(5)д��Na2CO3��Һ��CaO��Ӧ�����ӷ���ʽ��_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й����ռ�ʵ���ҡ������칬һ�š��Ĺ���ϵͳ�У�����������ȼ�ϵ�أ�RFC��������ԭ������ͼ��ʾ��a��b��c��d��ΪPt�缫��

����˵����ȷ����
A. B����OHͨ����Ĥ��a�缫�ƶ���A��pH����
B. c���������缫�ϵĵ缫��ӦΪ��2H++2e![]() H2��
H2��
C. ͼ���ҹ��е�OHͨ����Ĥ��c�缫�ƶ���d�缫�Ϸ���������Ӧ
D. ����1 mol����ת��ʱ����״���£�b�缫�����ϲ�������Y�����Ϊ11.2 L
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com