
【题目】利用硝酸厂尾气中较高浓度NOx气体(含NO、NO2)制备NaNO2、NaNO3,流程如下:
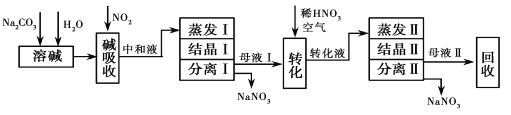
已知:NaOH+NO+NO2═2NaNO2+H2O
(1)写出Na2CO3溶液和NO、NO2反应的化学方程式_______________________________。
(2)中和液所含溶质除NaNO2及少量Na2CO3 外,还有少量___________和___________(填化学式)。
(3)中和液进行蒸发Ⅰ操作时,应控制水的蒸发量,避免浓度过大,目的是____________________;蒸发Ⅰ产生的蒸气中含有少量的NaNO2等有毒物质,不能直接排放,将其冷凝后用于流程中的______________(填操作名称)最合理。
(4)母液Ⅱ需 回收利用,下列处理方法合理的是________________________。
a.转入中和液 b.转入结晶Ⅰ操作 c.转入转化液 d.转入结晶Ⅱ操作
(5)NaNO2能与N2H4反应生成NaN3,该反应中NaNO2_____(填“被氧化”或“被还原”)
N2H4 的电子式是____________________,NaN3 中含有的化学键类型是______________________。
(6)若将NaNO2、NaNO3两种产品的物质的量之比设为2∶1,则生产1.38吨NaNO2时,Na2CO3的理论用量为________________吨(假定Na2CO3恰好完全反应)。
【答案】 Na2CO3+NO+NO2=2NaNO2+CO2 NaHCO3 NaNO3 防止NaNO3析出而降低NaNO2纯度 溶碱 c 被还原  离子键和(非极性)共价键 1.59
离子键和(非极性)共价键 1.59
【解析】(1)碳酸钠溶液显碱性,结合已知NaOH+NO+NO2═2NaNO2+H2O可得,Na2CO3溶液和NO、NO2反应生成NaNO2,根据原子守恒,还会有CO2生成,故反应的化学方程式为:Na2CO3+NO+NO2=2NaNO2+CO2。
(2)由制备流程可知,碳酸钠溶解后,碱吸收过程可能发生Na2CO3+NO+NO2=2NaNO2+CO2、3NO2+H2O=HNO3+NO、Na2CO3+2HNO3=NaNO3+H2O+CO2↑、Na2CO3+HNO3=NaNO3+NaHCO3等反应,所以中和液所含溶质除NaNO2及少量Na2CO3外,还有少量NaHCO3和NaNO3。
(3)中和液进行蒸发Ⅰ操作时,若水的蒸发量过大,则溶液浓度过大,可能有NaNO2析出,从而降低NaNO3的纯度;蒸发Ⅰ产生的蒸气中含有少量的NaNO2等有毒物质,不能直接排放,应循环利用提高利用率,所以将其冷凝后用于流程中的“溶碱”最合理。
(4)母液Ⅱ中的溶质主要是NaNO3,将其转入转化液之后再进行蒸发结晶等操作,可以提高利用率,所以合理处理的方法选c。
(5)NaNO2中N元素化合价为:+3价,N2H4中N元素化合价为:-2价,所以NaNO2与N2H4发生氧化还原反应生成NaN3,该反应中NaNO2被还原;N2H4为共价化合物,N元素化合价为-2价,H元素化合价为+1价,两个N原子间形成一对共用电子,每个N原子分别与2个H原子形成共用电子对,故电子式为: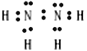 ;NaN3中含有活泼金属,故为离子化合物,Na+与N3-之间形成离子键,N3-内的N原子间形成(非极性)共价键。
;NaN3中含有活泼金属,故为离子化合物,Na+与N3-之间形成离子键,N3-内的N原子间形成(非极性)共价键。
(6)因为NaNO2、NaNO3两种产品的物质的量之比为2∶1,1.38吨NaNO2的物质的量为:1.38×106g÷69g/mol=2×104mol,则生成的NaNO3物质的量为:1×104mol,根据Na原子守恒,2n(Na2CO3)=n(NaNO2)+n(NaNO3),则Na2CO3的理论用量:m(Na2CO3)= ![]() ×(2×104+1×104)mol×106g/mol=1.59×106g=1.59吨。
×(2×104+1×104)mol×106g/mol=1.59×106g=1.59吨。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.天然油脂的分子中含有酯基,属于酯类
B.煤经处理变为气体燃料的过程属于物理变化
C. A12O3可以与水反应得到其对应水化物 Al(OH)3
D.可以用加热使蛋白质变性的方法分离提纯蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol·L-1HCl溶液滴定10.00mL浓度为0.1000 mol·L-1Na2CO3溶液,所得滴定曲线如图所示。已知H2CO3的Ka1=10-6.4,Ka2=10-10.2,下列说法不正确的是

A. m=11.6
B. 当V=5时,c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
C. 若用酚酞作指示剂,溶液由红色变为浅红色时,消耗盐酸体积约为10mL
D. 当V=a时c(Na+)>c(Cl-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,下图是某化工厂对海水资源综合利用的示意图:

请根据以上信息回答下列问题:
Ⅰ.(1)写出N的化学式和B的名称:N________,B________。
(2)写出反应②的化学方程式,并标出其电子转移的方向和数目________________。
(3)写出反应③的离子方程式____________________________________。
Ⅱ.粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:①盐酸 ②氯化钡溶液 ③氢氧化钠溶液④碳酸钠溶液,以上试剂添加的顺序可以为________。
A.②③④① B.③④②①
C.④③②① D.③②④①
Ⅲ.提取粗盐后剩余的海水(母液)中,可用来提取Mg和Br2。
(1)若用来提取Mg,根据上述提取Mg的流程,没有涉及的反应类型是________。
A.分解反应 B.化合反应
C.置换反应 D.复分解反应
(2)若用来提取Br2,反应⑥所用的气态氧化剂的寻找货源的设想,其中合理的是_____。
A.从外地购买
B.在当地新建生产厂
C.从本厂生产烧碱处循环
D.从本厂生产镁单质处循环
流程⑦将溴单质从混合物中分离出来是基于溴单质具有________性。
(3)母液用来提取Mg和Br2先后顺序,甲乙两位工程师有不同观点:
甲:母液先提取Mg,后提取Br2
乙:母液先提取Br2,后提取Mg
请你判断哪个更合适?________(填“甲”或“乙”),理由是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
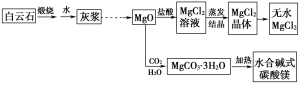
【题目】碱式碳酸镁和无水氯化镁具有广泛的用途。用白云石(CaCO3·MgCO3)为主要原料生产碱式碳酸镁和无水氯化镁的流程如下:
回答下列问题:
(1)“灰浆”中除水和MgO外,主要成分还有________________________。
(2)为探究所得的水合碱式碳酸镁[mMgCO3·nMg(OH)2·xH2O]的组成,某同学组装仪器如图所示:
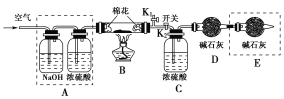
实验测得:硬质玻璃管中剩余的固体质量为1.60 g,C处浓H2SO4增重0.72 g,D处碱石灰(主要成分为氧化钙和氢氧化钠)增重1.32 g,此水合碱式碳酸镁的化学式为________。
(3)A框中装置的作用是___________________________________________;在装好试剂后,加热前应进行的操作是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香酯I的合成路线如下:

已知以下信息:
①A~I均为芳香族化合物,B苯环上只有一个取代基,且B能发生银镜反应;D的相对分子质量比C大4,E的核磁共振氢谱有3组峰。
②![]() ③
③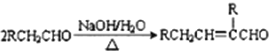
请回答下列问题:
(1)A→B的反应类型为____________,G中所含官能团的名称有____________________,E的名称是______________________________。
(2)B与银氨溶液反应的化学方程式为______________________________。
(3)I的结构简式为______________________________。
(4)符合下列要求A的同分异构体还有_______________种。
①与Na反应并产生H2 ②芳香族化合物
(5)据已有知识并结合相关信息,写出以CH3CH2OH为原料制备CH3CH2CH2CH2OH的合成路线流程图(无机试剂任选)。合成路线流程图示如下:CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3。
CH3COOCH2CH3。
_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常检测SO2含量是否达到排放标准的反应原理是SO2 +H2O2 + BaCl2 ===BaSO4↓+ 2HCl。NA表示阿伏伽德罗常数,下列说法正确的是( )
A. 0.1 mol BaCl2晶体中所含微粒总数为0.1NA
B. 25 ℃时,pH =1的HCl溶液中含有H+的数目为0.1NA
C. 17 g H2O2中含有非极性键数目为0.5NA
D. 生成2.33 g BaSO4沉淀时,转移电子数目为0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列实验现象及其解释不正确的是
A. 金属钠在Cl2中燃烧产生白烟,这是因为产生的NaCl固体颗粒分散到空气中所致
B. 把烧红的铁丝放在氧气中,发出耀眼白光,产生黑色固体,这是因为该反应放热多,生成的Fe3O4为黑色
C. 单质Mg、Al与O2反应,条件不同,可能产生不同的产物
D. 镁带在空气中点燃发出耀眼光芒,并发生三个反应:2Mg+O2![]() 2MgO、3Mg+N2
2MgO、3Mg+N2![]() Mg3N2、2Mg+CO2
Mg3N2、2Mg+CO2![]() 2MgO+C(黑色),Mg常用于照明弹。在这些反应中,Mg都是作还原剂
2MgO+C(黑色),Mg常用于照明弹。在这些反应中,Mg都是作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下:
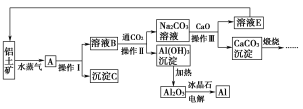
请回答下列问题:
(1)请说出沉淀C在工业上的一种用途:_____________________。
(2)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有_____(填化学式)。
(3)操作Ⅰ、操作Ⅱ和操作Ⅲ都是________(填操作名称)。实验室洗涤Al(OH)3沉淀的方法是__________________________________________。
(4)电解熔融的氧化铝,若得到标准状况下22.4 L O2,则同时生成铝的质量为________g。
(5)写出Na2CO3溶液与CaO反应的离子方程式:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com