
【题目】碱式碳酸镁和无水氯化镁具有广泛的用途。用白云石(CaCO3·MgCO3)为主要原料生产碱式碳酸镁和无水氯化镁的流程如下:
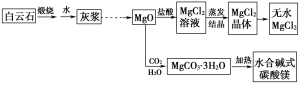
回答下列问题:
(1)“灰浆”中除水和MgO外,主要成分还有________________________。
(2)为探究所得的水合碱式碳酸镁[mMgCO3·nMg(OH)2·xH2O]的组成,某同学组装仪器如图所示:
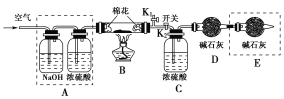
实验测得:硬质玻璃管中剩余的固体质量为1.60 g,C处浓H2SO4增重0.72 g,D处碱石灰(主要成分为氧化钙和氢氧化钠)增重1.32 g,此水合碱式碳酸镁的化学式为________。
(3)A框中装置的作用是___________________________________________;在装好试剂后,加热前应进行的操作是_______________________________。
【答案】Ca(OH)23MgCO3·Mg(OH)2·3H2O除去空气中的CO2等酸性气体和水蒸气,以减少误差打开K1,关闭K2,通入足量空气后,再打开K2,关闭K1
【解析】
(1)碳酸钙、碳酸镁分解得到氧化钙、氧化镁,氧化镁不溶于水,氧化钙可以和水反应得到Ca(OH)2,因此“灰浆”中除水和MgO外,主要成分还有Ca(OH)2。
(2)水合碱式碳酸镁的化学式为mMgCO3·nMg(OH)2·xH2O,受热分解生成氧化镁、二氧化碳和水。硬质玻璃管中剩余的固体质量为1.60g,即氧化镁是1.60g,物质的量是1.60g÷40g/mol=0.04mol。C处浓H2SO4增重0.72g,即生成的水是0.72g,物质的量是0.72g÷18g/mol=0.04mol。D处碱石灰(主要成分为氧化钙和氢氧化钠)增重1.32g,说明生成的二氧化碳质量是1.32g,物质的量是1.32g÷44g/mol=0.03mol。所以根据原子守恒可知m:n:x=0.03:(0.04-0.03):(0.04-0.01)=3:1:3,因此化学式为3MgCO3·Mg(OH)2·3H2O;
(3)实验需要通过测量D装置内碱石灰的增重,计算生成的二氧化碳的质量,通过测量C装置装置,计算生成的水的质量,而空气中含有水蒸气以及二氧化碳等,所以A框中装置的作用是除去空气中的CO2等酸性气体和水蒸气,以减少误差;由于要排除空气中的水以及二氧化碳的干扰,开始之前要先通空气,排尽装置中的空气,再进行试验,所以在装好试剂后,加热前应进行的操作是打开K1,关闭K2,通入足量空气后,再打开K2,关闭K1。


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】工业上常用水钴矿(主要成分为Co2O3,还含少量Fe2O3、 Al2O3、MgO、CaO等杂质) 制备钴的氧化物,其制备工艺流程如下:
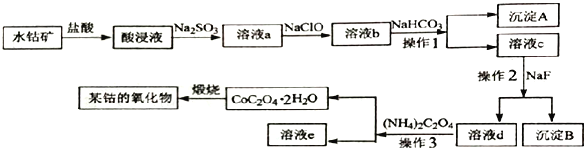
回答下列问题:
(1)在加入盐酸进行“酸浸”时,能提高“酸浸”速率的方法有______________(任写一种)。
(2)“酸浸”后加入Na2SO3,钴的存在形式为Co2+,写出产生Co2+反应的离子方程式_______________________________。
(3)溶液a中加入NaClO的作用为_______________________________。
(4)沉淀A 的成分为__________________。操作2的名称是___________________。
(5)已知: Ksp (CaF2)=5.3×10-9,Ksp(MgF2)=5.2×10-12,若向溶液c 中加入NaF溶液,当Mg2+恰好沉淀完全即溶液中c(Mg2+)=1.0×10-5moI/L,此时溶液中c(Ca2+)最大等于_________mol·L-1。
(6)在空气中煅烧CoC2O4 生成钴的某种氧化物和CO2,测得充分煅烧后固体质量为12.05 g,CO2的体积为6.72 L(标准状况),则此反应的化学方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+B ![]() C(g)+D 中,A、C都是无色气体,当达到平衡时,下列叙述错误的是
C(g)+D 中,A、C都是无色气体,当达到平衡时,下列叙述错误的是
A. 若增大A的浓度,平衡体系颜色加深,说明D是有颜色的气体
B. 增大压强,平衡不移动,说明B、D必是气体
C. 若B是气体,增大A的浓度会使B的转化率增大
D. 升温,C的质量分数减小,说明正反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列三个化学反应均能发生:
X2+2W2+![]() 2X-+2W3+
2X-+2W3+
Z2+2X-![]() 2Z-+X2
2Z-+X2
2W3++2Y-![]() 2W2++Y2
2W2++Y2
则在相同条件下,下列三个反应也能发生的是( )
①Y2+2X-![]() 2Y-+X2 ②Z2+2Y-
2Y-+X2 ②Z2+2Y-![]() 2Z-+Y2 ③2W3++2Z-
2Z-+Y2 ③2W3++2Z-![]() 2W2++Z2
2W2++Z2
A. 只有① B. 只有② C. ①和② D. ②和③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列有关说法正确的是
A. 足量的铜与40mL 10mol/L 硝酸反应,生成气体的分子数为0.2NA
B. 1.0L 1.0mol·L-1Na2SO4 水溶液中含有的氧原子数为4NA
C. 电解饱和食盐水,当阴极产生1.12LH2时,转移的电子数为0.1NA
D. 4.4g乙醛和丁酸的混合物完全燃烧,消耗氧分子的数目为0.25NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硝酸厂尾气中较高浓度NOx气体(含NO、NO2)制备NaNO2、NaNO3,流程如下:
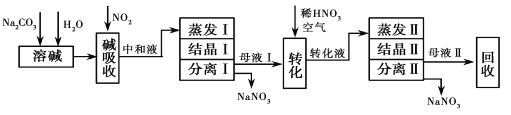
已知:NaOH+NO+NO2═2NaNO2+H2O
(1)写出Na2CO3溶液和NO、NO2反应的化学方程式_______________________________。
(2)中和液所含溶质除NaNO2及少量Na2CO3 外,还有少量___________和___________(填化学式)。
(3)中和液进行蒸发Ⅰ操作时,应控制水的蒸发量,避免浓度过大,目的是____________________;蒸发Ⅰ产生的蒸气中含有少量的NaNO2等有毒物质,不能直接排放,将其冷凝后用于流程中的______________(填操作名称)最合理。
(4)母液Ⅱ需 回收利用,下列处理方法合理的是________________________。
a.转入中和液 b.转入结晶Ⅰ操作 c.转入转化液 d.转入结晶Ⅱ操作
(5)NaNO2能与N2H4反应生成NaN3,该反应中NaNO2_____(填“被氧化”或“被还原”)
N2H4 的电子式是____________________,NaN3 中含有的化学键类型是______________________。
(6)若将NaNO2、NaNO3两种产品的物质的量之比设为2∶1,则生产1.38吨NaNO2时,Na2CO3的理论用量为________________吨(假定Na2CO3恰好完全反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年我国首艘使用了钛合金材料的国产航母下水。钛(Ti)常温下与酸、碱均不反应,但高温下能被空气氧化。由钛铁矿(主要成分是FeO和TiO2)提取金属钛的主要工艺流程如图,下列说法错误的是
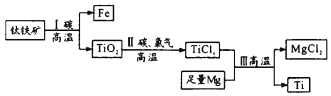
A. 步骤I中碳作还原剂
B. 步骤II中未发生氧化还原反应
C. 步骤III需在氩气环境中进行,防止金属被空气氧化
D. 可用稀硫酸除去金属钛中的少量镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A. 无色透明溶液:Al3+、NH4+、Cl-、S2-
B. 中性溶液:Al3+、Fe3+、SO42-、NO3-
C. 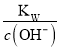 =1×10-13mol·L-1的溶液:Na+、K+、SiO32-、CO32-
=1×10-13mol·L-1的溶液:Na+、K+、SiO32-、CO32-
D. 0.1mol·L-1的NaClO溶液:Mg2+、Fe2+、SCN-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com