
【题目】可逆反应A(g)+B ![]() C(g)+D 中,A、C都是无色气体,当达到平衡时,下列叙述错误的是
C(g)+D 中,A、C都是无色气体,当达到平衡时,下列叙述错误的是
A. 若增大A的浓度,平衡体系颜色加深,说明D是有颜色的气体
B. 增大压强,平衡不移动,说明B、D必是气体
C. 若B是气体,增大A的浓度会使B的转化率增大
D. 升温,C的质量分数减小,说明正反应是放热反应
科目:高中化学 来源: 题型:
【题目】镍铬钢俗称不锈钢,在日常生活中应用广泛,含有铁、铬、镍、碳等元素。
请回答下列问题:
(1)镍的基态原子核外价层电子排布式为_______________,基态Fe3+有_____种不同运动状态的电子,基态铬原子有__________个未成对电子。
(2)配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是_______________(填元素符号),铬的高价化合物可将CH3CH2OH 氧化为CH3CHO,CH3CHO 中—CH3和—CHO 中碳原子的杂化方式分别为_______________、___________________。
(3)镍能与CO 形成Ni(CO)4,常温下Ni(CO)4是无色液体,易溶于有机溶剂,推测Ni(CO)4是__________晶体,组成Ni(CO)4的三种元素电负性由大到小的顺序为_______________(填元素符号),CO 分子中π键与σ键的个数比为_______________。
(4)NiO 的立方晶体结构如图所示,则O2-填入Ni2+构成的________空隙(填“正四面体”、“正八面体”、“ 立方体”或“压扁八面体”)。NiO晶体的密度为ρg·cm-3,Ni2+和O2-的半径分别为r1pm和r2pm,阿伏加德罗常数值为NA,则该晶胞中原子的体积占晶胞体积的百分率为___________________________________。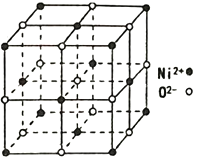
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机材料中间体。实验室由芳香化合物A制备H的一种合成路线如下;
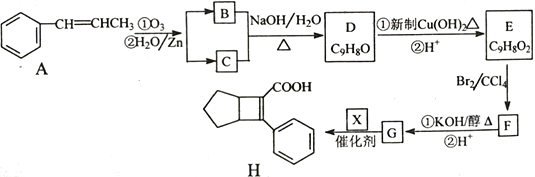
已知:①![]()
②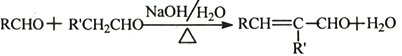
③![]()
请回答下列问题:
(1)芳香族化合物B的名称为__________,C的同系物中相对分子质量最小的结构简式为__________。
(2)由F生成G的第①步反应类型为_______________。
(3)X的结构简式为_______________。
(4)写出D生成E的第①步反应化学方程式____________________________。
(5)G与乙醇发生酯化反应生成化合物Y,Y有多种同分异构体,其中符合下列条件的同分异构体有__________种,写出其中任意一种的结构简式_____________________。
①分子中含有苯环,且能与饱和碳酸氢钠溶液反应放出CO2
②其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1。
(6)写出用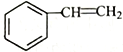 为原料制备化合物
为原料制备化合物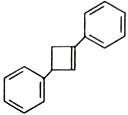 的合成路线,其它无机试剂任选_____________________________________________。
的合成路线,其它无机试剂任选_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol·L-1HCl溶液滴定10.00mL浓度为0.1000 mol·L-1Na2CO3溶液,所得滴定曲线如图所示。已知H2CO3的Ka1=10-6.4,Ka2=10-10.2,下列说法不正确的是

A. m=11.6
B. 当V=5时,c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
C. 若用酚酞作指示剂,溶液由红色变为浅红色时,消耗盐酸体积约为10mL
D. 当V=a时c(Na+)>c(Cl-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:Mo基催化剂的耐硫甲烷化反应会涉及WGS 或者RWGS 反应,主要反应式如下:
(1)CO和CO2甲烷化 CO(g)+3H2(g)=CH4(g)+H2O(g) ΔH1=-206.2kJ/mol
CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH2=-165.0kJ/mol
写出CO 与水蒸气反应生成CO2和H2的热化学方程式__________________________________。
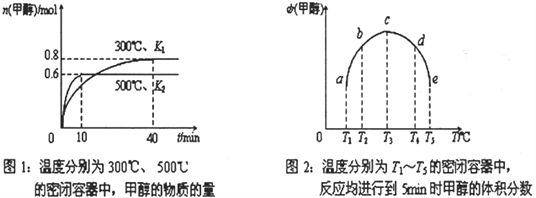
(2)CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH。现在容积均为1L 的a、b、c、d、e 五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
CH3OH(g) ΔH。现在容积均为1L 的a、b、c、d、e 五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
 ,
,
①该反应的ΔH__________0 (选填“<”、“>”或“=”)。
②在500℃条件下达平衡时CO 的转化率为______________________。
③计算在300℃条件下达平衡时K=________________________。
④将容器d 中的平衡状态转变到容器c中的平衡状态,可采取的措施有______________________。
Ⅱ:某电解装置如图所示,X、Y 均为惰性电极:
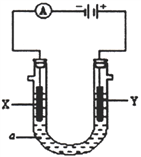
(3)若a溶液为滴有酚酞试液的NaNO3溶液,通电一段时间后X 电极及周围溶液的现象是:________________________________,Y 电极的电极反应式为______________________。
(4)若a 溶液为饱和CuCl2溶液,当电路中有0.2 mol 的电子通过时,阴、阳两电极的质量之差是__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸镁和无水氯化镁具有广泛的用途。用白云石(CaCO3·MgCO3)为主要原料生产碱式碳酸镁和无水氯化镁的流程如下:
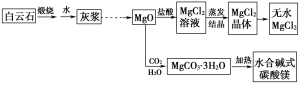
回答下列问题:
(1)“灰浆”中除水和MgO外,主要成分还有________________________。
(2)为探究所得的水合碱式碳酸镁[mMgCO3·nMg(OH)2·xH2O]的组成,某同学组装仪器如图所示:
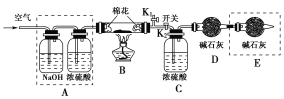
实验测得:硬质玻璃管中剩余的固体质量为1.60 g,C处浓H2SO4增重0.72 g,D处碱石灰(主要成分为氧化钙和氢氧化钠)增重1.32 g,此水合碱式碳酸镁的化学式为________。
(3)A框中装置的作用是___________________________________________;在装好试剂后,加热前应进行的操作是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图。若上端开口关闭,可得到强还原性的H+(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的·OH(烃基自由基)。下列说法错误的是

A. 无论是否鼓入空气,负极的电极反应式均为Fe-2e-=Fe2+
B. 不鼓入空气时,正极的电极反应式为H++e-=H·
C. 鼓入空气时,每生成1mol·OH有2mol电子发生转移
D. 处理含有草酸(H2C2O4)的污水时,上端开口应打开并鼓入空气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com